
The 35th ESMO Congress, Milan 2010
Abstract #LBA19/580O |
Cediranibは血管内皮増殖因子受容体 (VEGFR) チロシンキナーゼ阻害剤の経口薬であり、3種類のVEGFRを阻害する。複数の第I相試験から、FOLFOXとCediranibの併用により、その抗腫瘍効果が増強することが示されている1-2)。今回、転移性大腸癌初回治療例におけるFOLFOX + Cediranibの2つの大規模臨床試験結果が報告された (HORIZON II/III試験)。
|
Bevacizumabという高いハードル -大腸癌にTKIの夜明けは到来せず |
|
|
CediranibはVEGFR系チロシンキナーゼ阻害剤 (TKI: tyrosine kinase inhibitor) の経口薬であり、化学療法との併用により抗腫瘍効果を増強させ、Bevacizumabを凌ぐ次代の分子標的治療となることを期待されていた。今回は、placeboとの比較であるHORIZON II試験と、Bevacizumabとの直接対決となるHORIZON III試験の2つの試験結果が報告された。 |
Cediranib plus FOLFOX/XELOX versus placebo plus FOLFOX/XELOX in patients with previously untreated metastatic colorectal cancer: a randomized, double-blind, Phase III study (HORIZON II)
P.M. Hoff, et al.
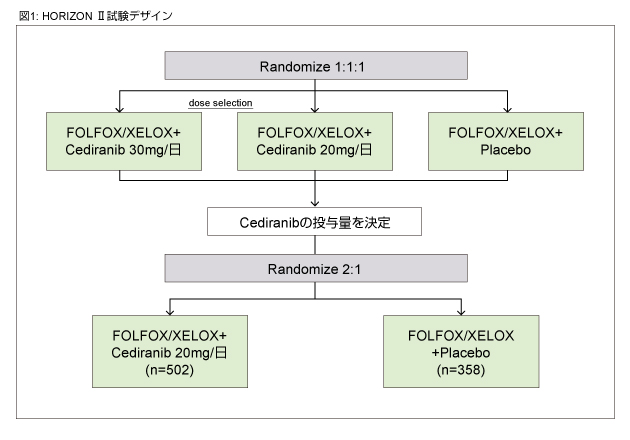
HORIZON II試験は、化学療法歴のない転移性大腸癌患者 (WHO PS 0/1) を対象とした国際共同無作為化比較二重盲検プラセボ対照第III相試験である。
FOLFOX/XELOX + Cediranib 20 mg/日、同 + Cediranib 30 mg/日、同 + placebo群に1: 1: 1の割合で無作為に割り付けた。Cediranibの投与量を20 mg/日に決定した後は、FOLFOX/XELOX + Cediranib 20 mg群と同 + placebo群に2: 1の割合で無作為に割り付けた (図1)。
- 一次エンドポイント
| Progression-free survival (PFS) | ||
| Overall survival (OS) |
- 二次エンドポイント
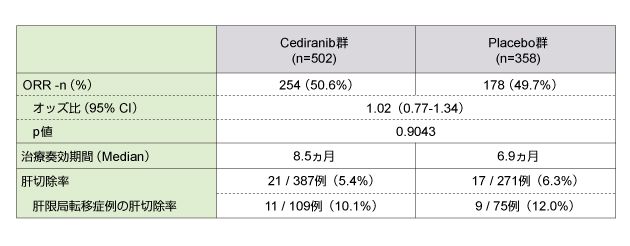
| Objective response rate (ORR)、duration of response (DoR: 治療奏効期間)、肝切除率、創傷治癒遅延発生率、安全性、忍容性 |
2006年9月〜2008年8月に860例 (FOLFOX/XELOX + Cediranib 20 mg群: 502例、同 + placebo群: 358例) が登録された。年齢中央値はそれぞれ58.0歳、59.0歳、男性: 59.6%、59.2%、WHO PS 0: 57.4%, 58.4%であった。併用化学療法は両群間に差はなく、両群合わせてFOLFOX4: 26.2%、mFOLFOX6: 17.1%、XELOX: 56.7%であった。
Cediranib群とplacebo群のPFSはそれぞれ8.6ヵ月、8.2ヵ月 (HR=0.84、95%CI: 0.73-0.98、p=0.0121) であり、Cediranib群において有意な延長が認められたが、OSは19.7ヵ月、18.9ヵ月 (HR=0.94、95%CI: 0.79-1.12、2-sided p=0.5707) であり、有意差は得られなかった。その他の有効性は下表に示す通りである。
CTCAE Grade 3以上の有害事象の発生率はCediranib群で高く (Cediranib群: 77.8%、placebo群: 62.0%)、重篤な有害事象 (SAE*) についても同様であった (40.8%、29.3%)。特にCediranib群で多くみられた有害事象は、下痢 (71.0%、48.0%)、嘔吐 (46.6%、36.6%)、高血圧 (46.0%、12.0%)、食欲不振 (45.8%、35.2%)、疲労 (40.6%、29.1%)、口内炎 (23.8%、13.7%) などであった。
試験開始後6ヵ月間の併用化学療法のdose intensity (用量強度) 中央値はCediranib群で低く、placebo群に比べて約10%の減少が認められた。
| *SAE: serious adverse event |
FOLFOX/XELOX + Cediranib は一次エンドポイントであるPFSを有意に延長したものの、OSおよびORR、DoR、肝切除率については有意差が得られなかった。Cediranib群の有害事象は過去の報告と同様であったが、Grade 3以上の有害事象の発生率がplacebo群に比して高率であった。また、Cediranibに関連する有害事象はコントロール可能であったが、併用化学療法の用量強度の低下につながった。
mFOLFOX6 + cediranib versus mFOLFOX6 + bevacizumab in previously untreated metastatic colorectal cancer: a randomized, double-blind, Phase II/III study (HORIZON III)
H-J. Schmoll, et al.
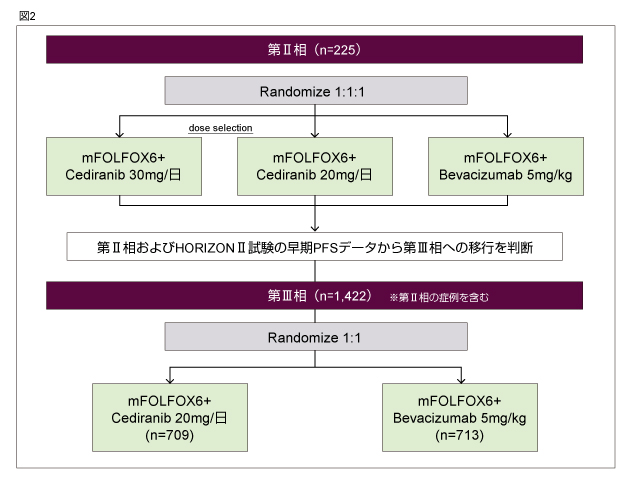
HORIZON III試験は、化学療法歴のない転移性大腸癌患者におけるmFOLFOX6 + CediranibとmFOLFOX6 + Bevacizumabの有用性を比較・検討した国際共同無作為化二重盲検第II/III相試験である (図2)。第II相から第III相への移行は、本試験の第II相およびHORIZON II試験のデータをもとに決定する。
- 一次エンドポイント
| Progression-free survival (PFS) | ||
| 優越性が示されなかった場合は非劣性検定を実施。HRの95%CI上限を1.2未満とした。 |
- 二次エンドポイント
| Overall survival (OS)、objective response rate (ORR)、duration of response (DoR: 治療奏効期間)、QOL、安全性、忍容性 |
2006年8月〜2009年1月までに1,422例が登録された (Cediranib群: 709例、Bevacizumab群: 713例)。
Cediranib 群とBevacizumab群のPFSは、それぞれ9.9ヵ月、10.3ヵ月 (HR=1.10、95% CI: 0.97-1.25、p=0.1190) であり、有意差は認められなかった。また、非劣性についてもHRの95% CIが上限の1.2を超えていたため示されなかった。
OSはCediranib群で22.8ヵ月、Bevacizumab群では21.3ヵ月 (HR=0.94、p=0.5459)、ORRは46.3%、47.3% (OR 0.96、p=0.6719)、DoRは8.6ヵ月、9.6ヵ月 (p=0.202) であり、いずれも有意差はみられなかった。QOLスコア (FACT-C) は、Bevacizumab群が有意に優れていた (HR=1.36、p<0.0001)。
5%以上のGrade 3/4の有害事象は、好中球減少 (Cediranib群: 31.8%、Bevacizumab群: 23.6%)、下痢 (13.8%、5.8%)、疲労 (7.8%、4.8%)、末梢神経障害 (7.2%、9.7%)、高血圧 (7.0%、4.1%)、感覚性末梢神経障害 (5.8%、5.3%) であり、好中球減少と下痢はCediranib群で特に高値であった。mFOLFOX6の治療サイクル数はCediranib群で少なかった。
mFOLFOX6 + CediranibはmFOLFOX6 + Bevacizumabに比べ、PFS、OS、ORRのいずれにおいても有意差がみられず、またPFSにおける非劣性も示されなかった。有害事象やQOLはBevacizumab群のほうが良好であった。Cediranibに関連した有害事象はコントロール可能であったが、mFOLFOX6の投与量の減少がPFSに影響を及ぼしたと考えられた。
HORIZON II試験では、Cediranibの併用による有意なPFSの延長が認められ、PFSのHRはNO16966試験4)のFOLFOX/XELOX + Bevacizumab群と同等であった (HORIZON II: HR=0.84、NO16966: HR=0.83)。本試験では、有効性におけるBevacizumab群との有意差はみられなかったが、Bevacizumabよりも毒性が強く、実臨床への応用は限られるであろう。
| Reference | ||
| 1) | Drevs J, et al.: J Clin Oncol. 25(21): 3045-3054, 2007 [PubMed] | |
| 2) | Chen E, et al.: Clin Cancer Res. 15(4): 1481-1486, 2009 [PubMed] | |
| 3) | Hecht JR, et al.: 2005 Annual Meeting of the American Society of Clinical Oncology®: abst #3 | |
| 4) | Saltz LB, et al.: J Clin Oncol. 26(12): 2013-2019, 2008 [PubMed] | |

