背景と目的
進行食道胃腺癌は予後不良であり、1st-lineまたは2nd-lineの化学療法に不応になった後の治療選択肢は限られている。Regorafenibは血管新生 (VEGFR1-3, TIE-2)、腫瘍微小環境 (PDGFR, FGFR)、腫瘍増殖 (RAF, RET, KIT) などに関わる因子を標的にする経口マルチキナーゼ阻害剤であり、大腸癌1)、GIST2)でその有効性が確認されている。今回、進行食道胃腺癌に対する有効性と安全性を評価するため、オーストラリア (AGITG)、カナダ (NCIC-CTG)、韓国による国際共同試験が行われた。
対象と方法
1もしくは2レジメンの治療歴があり、標的病変を有する局所進行性または再発性食道胃腺癌 (未分化癌を含む) を対象とし、Regorafenib群 (160mg/日, day1-21, 28日毎) とプラセボ群に無作為に2:1に割り付けられた (図1)。割り付け因子は前治療レジメン数 (1レジメン、2レジメン)、地域 (オーストラリア、カナダ、韓国) であった。
図1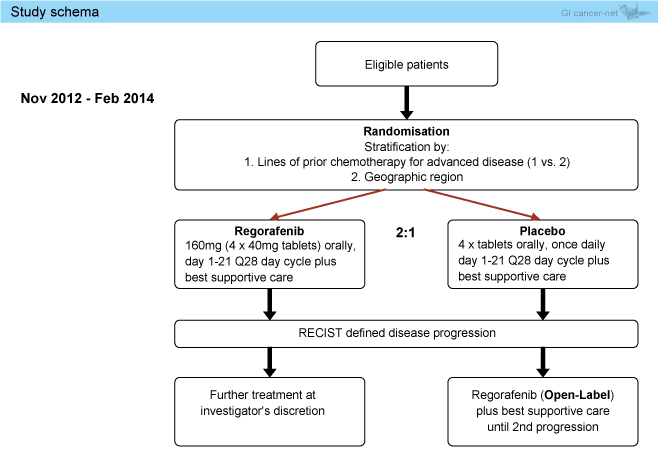
主要評価項目はPFS、副次評価項目は奏効率、OS、安全性、QOLなどであった。試験はRegorafenib群の2ヵ月PFSの閾値を50%、期待値を66%としてβ=0.1、α=0.05から必要症例数を算出し、Regorafenib群100例、プラセボ群50例としてデザインされた。なお、プラセボ群ではRECIST基準で増悪が確認されたのち、オープンラベルでのRegorafenib投与が許容された。
結果
2012年11月~2014年2月までに登録された152例のうち、適格基準を満たした147例 (Regorafenib群97例、プラセボ群50例) を主解析の対象とした。患者背景は両群で同様であった (表)。
表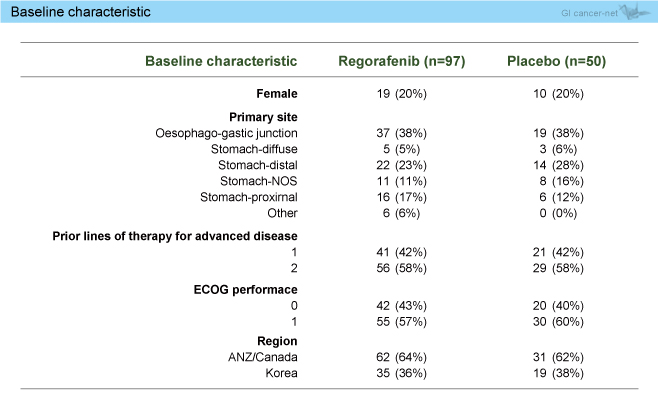
主要評価項目のPFS中央値はRegorafenib群2.6ヵ月、プラセボ群0.9ヵ月であり、Regorafenib群で有意に延長した (HR=0.40, 95% CI: 0.28-0.59, p<0.0001) (図2)。奏効率は3% vs. 2%と差を認めず、病勢コントロール率は43% vs. 16%と、Regorafenib群で良好であった。
図2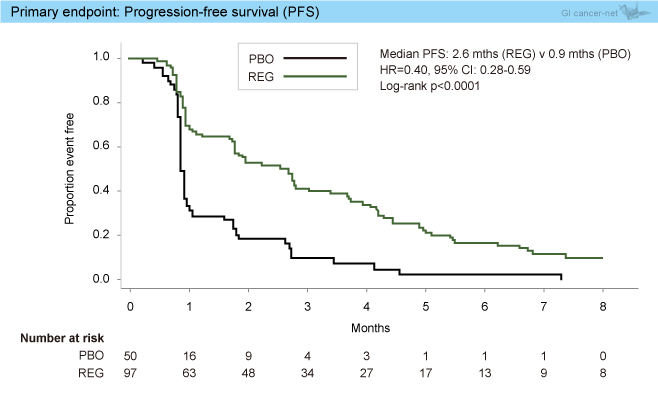
PFSのサブグループ解析では、地域で若干の差を認めたものの (オーストラリア/カナダ vs. 韓国:HR=0.61 vs. HR=0.12, p=0.0009)、年齢、治療レジメン数、腹膜転移の有無、転移臓器個数、血漿VEGF値では交互作用は認められなかった。
プラセボ群50例のうち29例が増悪後にRegorafenibの投与を受けた。OS中央値はRegorafenib群5.8ヵ月、プラセボ群4.5ヵ月であり、有意差はないもののRegorafenib群で良好な傾向を認めた (HR=0.74, 95% CI: 0.51-1.08, p=0.11) (図3)。
図3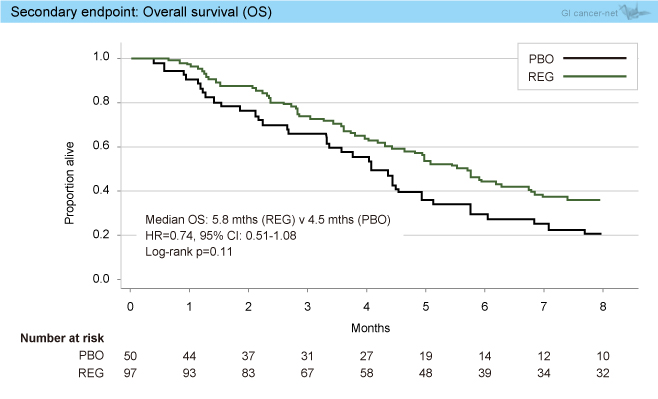
Regorafenib群の有害事象は、高血圧 (grade 3以上:10%)、AST/ALT上昇 (9/8%) 等がみられ、大腸癌におけるRegorafenib療法に関する臨床試験 (CORRECT試験) で認められた有害事象と同様であった。
結論
進行胃食道腺癌に対するRegorafenib療法の有効性が示唆された。地域により多少の効果の差があったが、すべてのサブグループでPFS延長が認められた。今後、AGITGを中心に第III相試験が行われる予定である。
コメント
プラチナ製剤を含む1st-lineあるいは2nd-line治療に不応の食道胃接合部癌あるいは胃癌を対象にしたマルチキナーゼ阻害剤であるRegorafenibとプラセボの無作為化第II相試験である。適格基準に扁平上皮癌は除かれていること、およびサブグループ解析において食道胃接合部癌も胃癌も同様な結果であったため、本邦での胃癌治療に応用できるデータと考える。ただし、本試験は有用性の検証試験ではないことに注意したい。結論は、第III相試験に進めるに十分な根拠が得られた。一方、discussionでは、統計学的有意差と臨床的意義は必ずしも同一ではないと言及されていた。確かに発表では忍容性が高いと報告したが、事実、腫瘍増大による治療中断がプラセボ80%に対してRegorafenibは64%で、有害事象による中止率が高かった。次回の試験では、Regorafenib特有の皮膚障害や肝機能障害について、より詳細に検討すべきである。胃癌の2nd-line化学療法の有用性が検証されている現在では、2nd-lineのRamucirumab + Paclitaxelあるいは、全標準治療不応例におけるBSCとの比較が妥当な候補と考えられる。今後の結果を期待したい。
(レポート:谷口 浩也 監修・コメント:佐藤 温)


