背景と目的
LapatinibはHER2陽性乳癌で有効性が証明され、保険承認されているEGFR/HER2阻害剤であり、HER2陽性胃・食道胃接合部癌に対して、単剤でも有望な結果が報告されている1)。そこで、HER2陽性切除不能・進行胃・食道胃接合部癌に対する1st-lineにおいて、Capecitabine + L-OHP (CapeOx 療法) に対するLapatinibの上乗せ効果を検証する国際第III相試験、TRIO-013/LOGiC試験が実施された。
対象と方法
対象は、PS 0-2、HER2陽性切除不能・進行胃・食道胃接合部癌に対する初回治療例である。FISHによるHER2増幅は施設判定もしくは中央判定とし、免疫染色 (IHC)、CISH、SISHも許容した。IHCの場合は3+を適格とした。また、中央判定のための組織提出は必須とした。
対象をCapeOx + Lapatinib群 (Lapatinib 1,250mg, qd, day1-21内服、Capecitabine 850mg/m2, bid, day1-14内服、L-OHP 130mg/m2, iv, day1, q3w)とCapeOx + placebo群に無作為割付けした (割付け調整因子 : 術後補助化学療法の有無と地域)。
主要評価項目は、試験開始時はPFSであったが、2009年9月にOSに変更された。副次評価項目はPFS、奏効率、奏効期間、有害事象、QOLなどであった。
CapeOx + Lapatinib群のCapeOx + placebo群に対するHRを0.735とし、CapeOx + Lapatinib群の優越性を検証した (両側α5%、検出力80%)。これは、OS中央値の14ヵ月 vs. 10.3ヵ月に相当する。
結果
22ヵ国の186施設から545例が登録された (primary efficacy populationは487例)。両群の患者背景に偏りはなかった (表1)。
表1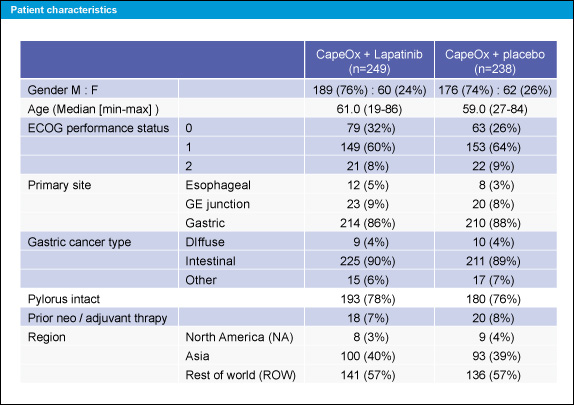
OS中央値はCapeOx + Lapatinib群が12.2ヵ月、CapeOx + placebo群が10.5ヵ月であり、両群間に有意差はなかった (HR=0.91, 95% CI: 0.73-1.12, p=0.3492) (図1)。
図1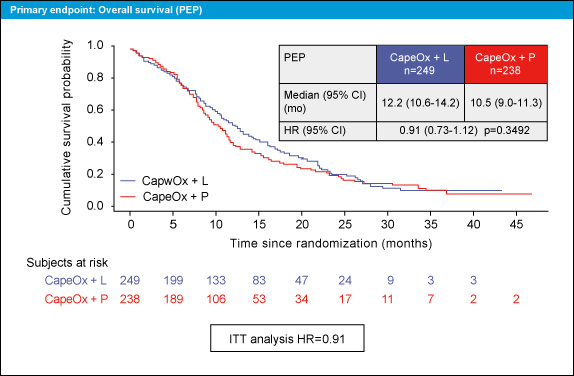
OSにおけるサブグループ解析では、60歳未満 (HR=0.69, 95% CI: 0.51-0.94)、アジア(HR=0.68, 95% CI: 0.48-0.96) のサブグループでCapeOx + Lapatinib群が良好であった (図2)。また、IHC 0-1、IHC 2-3のいずれのサブグループでもCapeOx + Lapatinib群が良好な傾向が認められた。
図2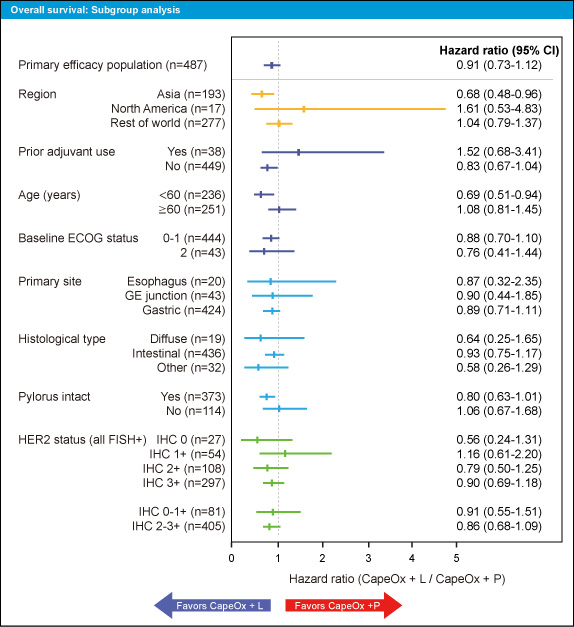
PFSはセンサーを考慮した場合、中央値はCapeOx + Lapatinib群が6.0ヵ月、CapeOx + placebo群が5.4ヵ月であり、CapeOx + Lapatinib群で有意に良好であった (HR=0.82, 95% CI: 0.68-1.00, p=0.0381) (図3)。
図3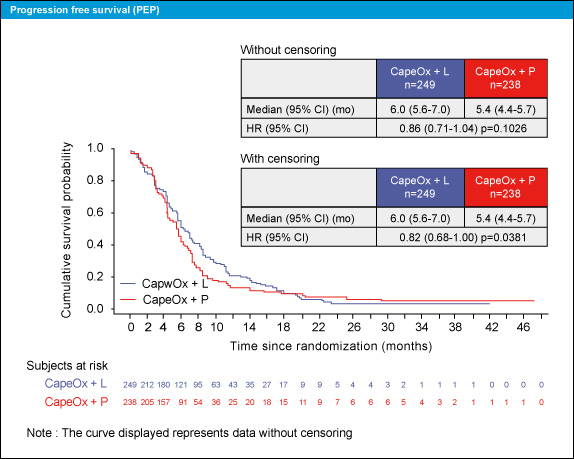
奏効率はCapeOx + Lapatinib群で53%、CapeOx + placebo群で40%であった。また、地域によって奏効率が異なっていた (表2)。
表2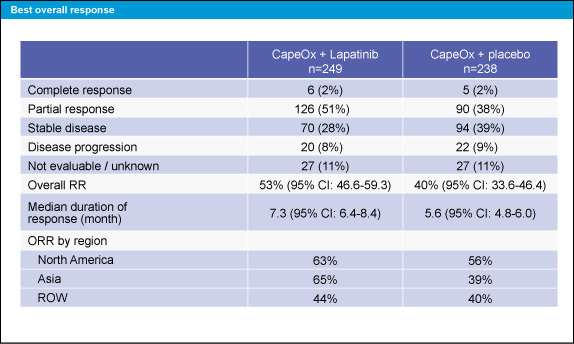
Grade 3以上の下痢 (12% vs. 3%)、すべてのgradeの皮疹 (21% vs. 7%)、手足症候群 (20% vs. 13%) の頻度は、いずれもCapeOx + Lapatinib群で高かった。
表3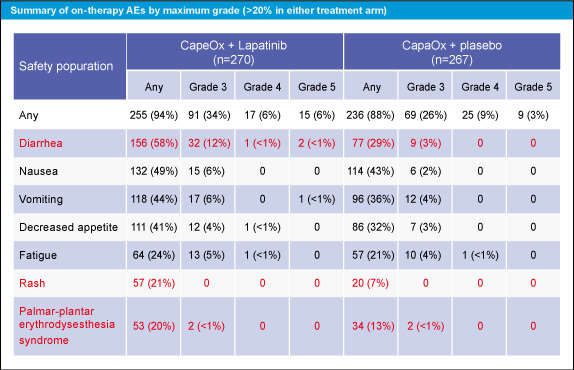
結論
HER2陽性切除不能・進行胃・食道胃接合部癌に対する1st-lineとしてのCapecitabine + L-OHP + Lapatinib療法は、Capecitabine + L-OHP療法に対して、OSにおける優越性を証明することはできなかった。
コメント
注目されていた研究報告だが、残念な結果であった。Lapatinibは、フッ化ピリミジン系抗癌剤に不応の進行胃癌患者において、2nd-lineでのweekly Paclitaxelとの併用効果を検討する国際共同第III相試験 (TyTAN試験) の結果もすでにnegativeと報告されている2)。この時もglobal studyにおける地域差異から、日本の参加が危惧されることになったのだが、本試験には日本は不参加であった。しかし、今回もアジアとその他の国々とのデータの差異が注目されており、global studyでの開発の難しさをより一層感じる。
Lapatinibは、乳癌においてTrastuzumab抵抗性の症例を対象に、Capecitabine単独群(2,500mg/m2/day、2週投与・1週休薬) とCapecitabine + Lapatinib併用群 (Capecitabine : 2,000mg/m2/day、2週投与・1週休薬/ Lapatinib : 1,250mg/day、連日投与) との第III相試験が行われ、Lapatinibの有効性が示されており、現在、Trastuzumab治療歴を有するHER2陽性転移乳癌患者の標準治療と位置付けられている。本試験は、初回治療例を対象として行われ、主要評価項目にmetせずnegativeとなったが、今後、Trastuzumab抵抗性胃癌を対象としての臨床研究の余地はある。また、詳細はわからないが、本試験では副作用中止が両群ともに20%あり、細胞障害性薬に引っ張られて早めにLapatinib投与が中止されたことによる影響が、PFSでの18ヵ月、OSでの24ヵ月から両群に差がなくなる原因となった可能性は否定できない。
(レポート:中島 貴子 監修・コメント:佐藤 温)
- Reference
-
- 1) Iqbal S, et al.: Ann Oncol. 22(12): 2610-2615, 2011 [PubMed]
- 2) Schwartzberg LS, et al.: 2013 Gastrointestinal Cancers Symposium: abst #11



