背景と目的
ML18147試験1)において、進行・再発大腸癌に対しBevacizumabを含む1st-line治療後、2nd-lineもBevacizumabを継続投与することによってOS (overall survival) の延長が認められている。一方SPIRITT試験2)では、進行・再発大腸癌の2nd-line治療としてPanitumumab群はBevacizumab群に比しPFS (progression-free survival) が長い傾向が認められたが、有意差は認められなかった。本試験は、Bevacizumab併用L-OHPベースレジメンによる1st-line治療不応の進行・再発大腸癌の2nd-lineにおけるBevacizumab継続投与の至適用量を検証することを目的に本邦で行われた多施設共同無作為化第III相試験 (EAGLE試験) である。
対象と方法
対象は1st-lineのBevacizumab併用L-OHPベースレジメンによる治療後に病勢進行を認めたか、なんらかの理由で治療を中止した20歳以上、ECOG PS 0/1の進行・再発大腸癌患者である。対象はFOLFIRI + Bevacizumab 5mg/kg群 (5mg/kg群)、またはFOLFIRI + Bevacizumab 10mg/kg群 (10mg/kg群) に1 : 1で無作為に割り付けられた (図1)。
図1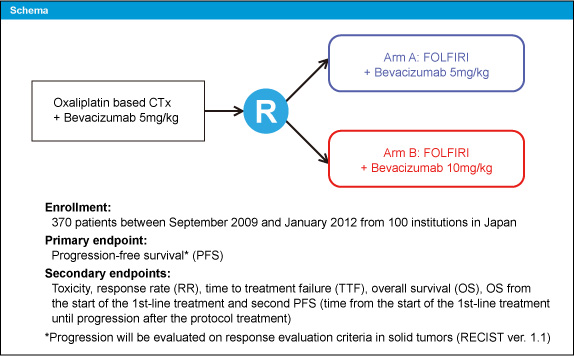
主要評価項目はPFSであり、副次評価項目は無増悪期間 (TTF)、1st-line治療開始からのPFS、奏効率、安全性である。90%の検出力 (両側有意水準5%) で30%のリスク低下を検出するために、目標症例数を370例とした。
結果
2009年9月~2012年1月の間に387例が登録され、369例が解析対象となった (5mg/kg群181例、10mg/kg群188例)。両群の患者背景は同等であった。
主要評価項目のPFSは5mg/kg群6.1ヵ月、10mg/kg群6.4ヵ月と両群間に有意差は認められなかった (HR=0.95, 95% CI: 0.75-1.21, p=0.676) (図2)。
図2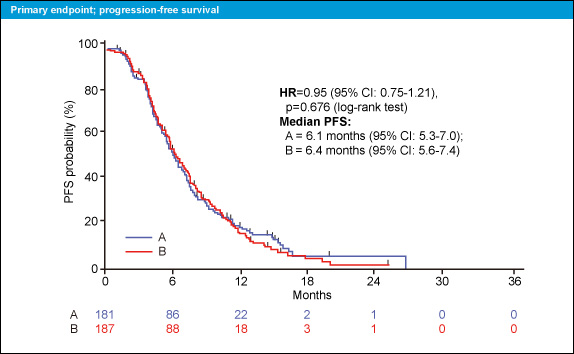
また、1st-line治療開始からのPFSも各17.4ヵ月、17.6ヵ月と両群同等であった (HR=1.00, 95% CI: 0.79-1.26, p=0.976) (図3)。
図3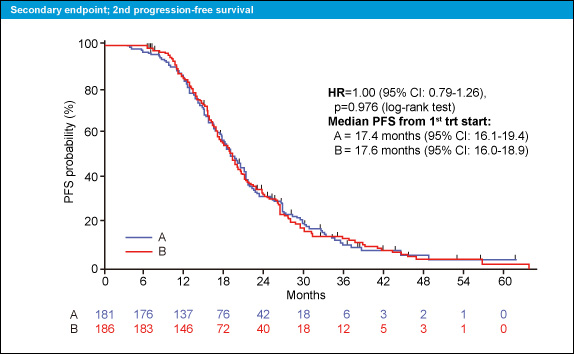
奏効率は5mg/kg群11.1%、10mg/kg群10.7%であり、両群間に有意差は認められなかった (p=1.00)。なお、PFSのサブグループ解析の結果、直腸癌 (HR=0.73, 95% CI: 0.51-1.05)、1st-lineが180日未満 (HR=0.75, 95% CI: 0.46-1.24)、ベースラインのCEAが20ng/mL以上 (HR=0.82, 95% CI: 0.60-1.13)、標的病変の合計が50mm以上 (HR=0.81, 95% CI: 0.59-1.12) の患者群では、10mg/kgによる治療のベネフィットが大きい傾向が認められた。
Grade 3以上の有害事象は、好中球減少が5mg/kg群48.3%、10mg/kg群41.6%、倦怠感が各8.3%、11.4%、食欲不振が各6.1%、5.4%に認められた。また、Bevacizumabに起因する有害事象 (全grade) は高血圧14.5%、18.9%、蛋白尿39.7%、36.8%、消化管穿孔0.6%、0.5%に認められ、治療関連死は各群2例認められた。なお、相対用量強度は両群ともに良好であった (表)。
表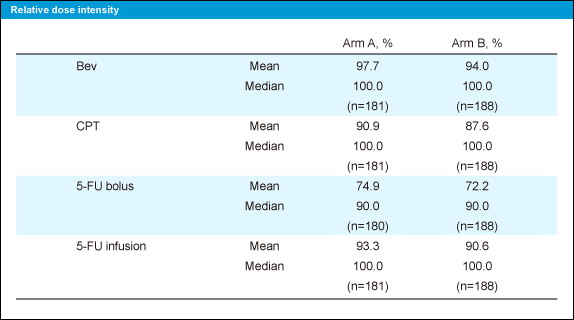
結論
本試験ではBevacizumab 10mg/kg投与の優越性は証明されず、有害事象も既報の通りであったことから、2nd-lineにおける継続的なBevacizumab投与の至適用量は5mg/kgであると考えられた。しかし、直腸癌、1st-lineが180日未満、ベースラインのCEAが20ng/mL以上、標的病変の合計が50mm以上の患者群では、Bevacizumab 10mg/kg投与によるベネフィットが得られる可能性が示唆された。
コメント
切除不能進行・再発大腸癌の化学療法におけるBBPの正当性はML18147試験によって証明された。本試験は、BBPにおけるBevacizumabの至適用量を模索するものである。PFSで判断した抗腫瘍効果および有害事象に関してBevacizumab 5mg/kgと10mg/kgの両群間差はなかった。この用量の範囲内では、Bevacizumabの抗腫瘍効果、毒性ともに用量依存ではないと考えられる。なお、Bevacizumabの増量によりベネフィットを得られる症例の特定には、本試験の結果は不十分と言わざるを得ない。
(レポート:岩本 慈能 監修・コメント:大村 健二)
- Reference
-
- 1) Bennouna J, et al.: Lancet Oncol. 14(1): 29-37, 2013 [PubMed]
- 2) Hecht RJ, et al.: 2013 Gastrointestinal Cancers Symposium: abst #454



