背景と目的
DREAM試験は、切除不能進行・再発大腸癌に対する1st-line治療後の維持療法としてBevacizumab (Bev) にErlotinibを併用することの有用性を検討する第III相試験である。昨年の米国臨床腫瘍学会では、Erlotinibの併用により維持療法開始からのPFS (progression-free survival) が有意に延長することが報告されている1)。今回、DREAM試験の最新結果と探索的解析としてKRAS status別の結果が報告された。
対象と方法
対象は未治療の切除不能進行・再発大腸癌である。導入療法としてmFOLFOX7/XELOX/FOLFIRI + Bev療法のいずれかの治療を施行した後、病勢進行を認めなかった患者が、維持療法としてBev療法、またはBev + Erlotinib療法を行う群に無作為に割り付けられた。なお、治療は病勢進行または不忍容な有害事象が発現するまで続けられた。主要評価項目は維持療法開始からのPFS、副次評価項目は登録時からのPFS、登録からのOS (overall survival)、KRAS status別のsurvivalなどである。
結果
DREAM試験のフローチャートを図1に示す。KRAS statusはBev群 (228例) がKRAS 野生型111例、変異型95例、不明22例、Bev + Erlotinib群 (224例) がそれぞれ129例、78例、17例であった。なお、両群の患者背景に差は認められなかった。
図1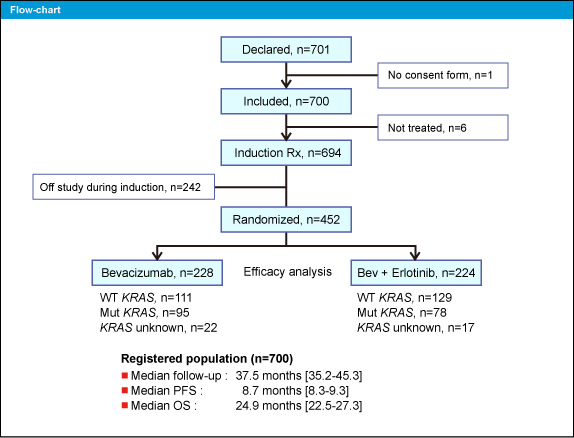
維持療法開始時点からのPFS中央値は、Bev群4.6ヵ月、Bev + Erlotinib群5.9ヵ月とBev + Erlotinib群で有意に良好であった (HR=0.76, 95% CI: 0.61-0.94, p=0.0096) (図2)。また、登録からのPFS中央値はBev群9.3ヵ月、Bev + Erlotinib群10.2ヵ月とBev + Erlotinib群で有意に良好であったが (HR=0.75, 95% CI: 0.61-0.93, p=0.0088)、登録からのOS中央値はそれぞれ27.9ヵ月、28.4ヵ月であり、有意差は認められなかった (HR=0.89, 95% CI: 0.70-1.12, p=0.8857) (図2)。Grade 3以上の有害事象は、Bev + Erlotinib併用群はBev群と比較し、下痢 (9% vs. 1%)、皮膚障害 (20% vs. 0%) の発現が多くみられた。
図2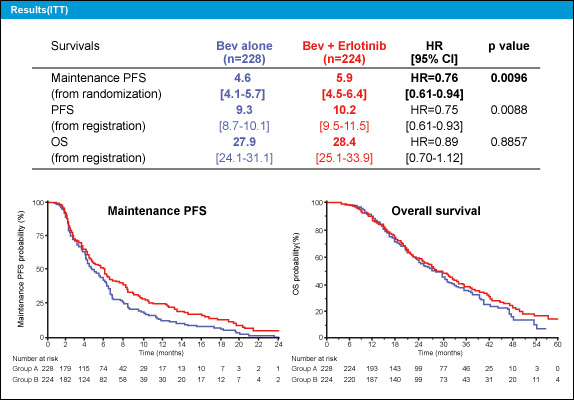
KRAS status別の解析では、維持療法開始時点からのPFS中央値はKRAS 野生型がBev群5.9ヵ月、Bev + Erlotinib群6.0ヵ月 (HR=0.86, 95% CI: 0.64-1.16, p=0.135)、KRAS 変異型がそれぞれ4.4ヵ月、4.7ヵ月 (HR=0.77, 95% CI: 0.54-1.08 p=0.124) と、いずれにも有意差を認めなかった。また、KRAS 野生型における登録からのPFSは、中央値がBev群9.7ヵ月、Bev + Erlotinib群10.9ヵ月 (HR=0.83, 95% CI: 0.61-1.11, p=0.197)、OS中央値はBev群31.5ヵ月、Bev + Erlotinib群31.8ヵ月 (HR=0.92, 95% CI: 0.66-1.30, p=0.644) であり、いずれにも有意差を認めなかった (図3)。
図3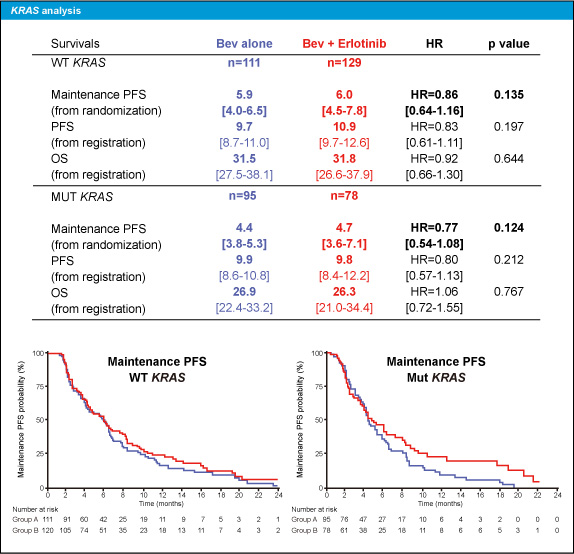
結論
切除不能進行・再発大腸癌に対する1st-line治療後のBevによる維持療法へのErlotinib併用は有意にPFSを延長したが、OSへの有意な効果は認められなかった。また、抗EGFR抗体薬とは対照的に、切除不能進行・再発大腸癌に対するErlotinib療法はKRAS statusによる影響を受けないと考えられた。
コメント
2012年米国臨床腫瘍学会で報告されたものに観察期間が追加された本報告でも、やはり全症例のPFSはErlotinib併用群で有意に延長していた。一方、両群のOSの曲線はほぼ重なっている。したがって、分子標的治療薬の併用による有害事象の増加、薬剤費の上乗せ等を勘案すると、PFSの有意な延長を根拠としてこの併用療法を実臨床に受け入れることの妥当性には疑問が残る。Biomarkerを用いたpatient selectionによってより効果を期待できる集団を拾い上げることができれば、その疑問を解消する糸口が見えたかもしれない。しかし、KRAS 野生型とKRAS 変異型のいずれにおいても維持療法開始後のPFSやOSに有意差を認めなかった。サブ解析によって有意差がなくなったのには、1群の症例数が減少したことも影響していると思われる。なお、これにNRAS やBRAF 変異の解析を追加して結果が変わる可能性はほとんどないと考えられる。
(レポート:岩本 慈能 監修・コメント:大村 健二)
- Reference
-
- 1) Tournigand C, et al.: 2012 Annual Meeting of the American Society of Clinical Oncology®: abst #LBA3500



