背景と目的
Regorafenibは血管新生性 (VEGFR、TIE-2) 、間質組織性 (PDGFR-β、FGFR) 及び腫瘍形成性 (c-KIT、RET、B-RAF) 受容体チロシンキナーゼを標的とする経口マルチキナーゼ阻害剤である。今回、標準治療抵抗性となった切除不能進行・再発大腸癌におけるRegorafenibの有効性を検証する第III相比較試験の結果が報告された。
対象と方法
対象は標準治療*抵抗性となった切除不能進行・再発大腸癌患者であり、Regorafenib群 (Regorafenib 160mg/day、3週投与1週休薬+BSC) とplacebo (placebo 3週投与1週休薬 + BSC) 群とに2:1の割合で無作為に割付けた (層別化因子:血管新生阻害剤の使用有無、診断から登録までの期間、地域) 。
*Fluoropyrimidine、Oxaliplatin, Irinotecan, Bevacizumab, Cetuximab/Panitumumab (KRAS 野生型患者)
主要評価項目はOS (overall survival) で、期待される両群間の差 33.3% (HR: 0.75) 、片側α=0.025、検出力90%より必要症例数を690例とした。副次的評価項目はPFS (progression-free survival)、ORR (overall response rate)、DCR (disease control rate) である。
結果
2010年5月から2011年3月の間に16ヵ国114施設より760例が登録された。 Regorafenib群は505例、placebo群255例であり、両群間の患者背景に大きな隔たりはなかった。
Regorafenib群では、placebo群と比較して有意にOS (図1:HR: 0.77、p=0.0052、中央値6.4ヵ月 vs. 5.0ヵ月) 及びPFS (HR: 0.49、p<0.000001、中央値1.9ヵ月 vs. 1.7ヵ月)が延長していた。ORRは各々1.0%、0.4%と差は認めなかったが、DCRはRegorafenib群で41.0%と、placebo群の14.9%に比べ有意に良好であった (p<0.000001) 。
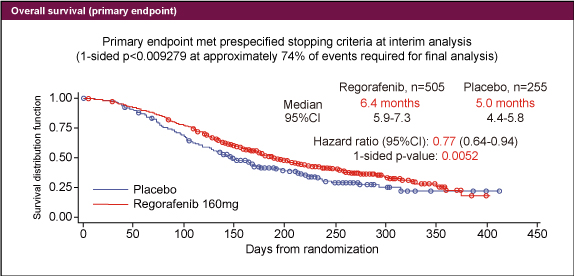
図1
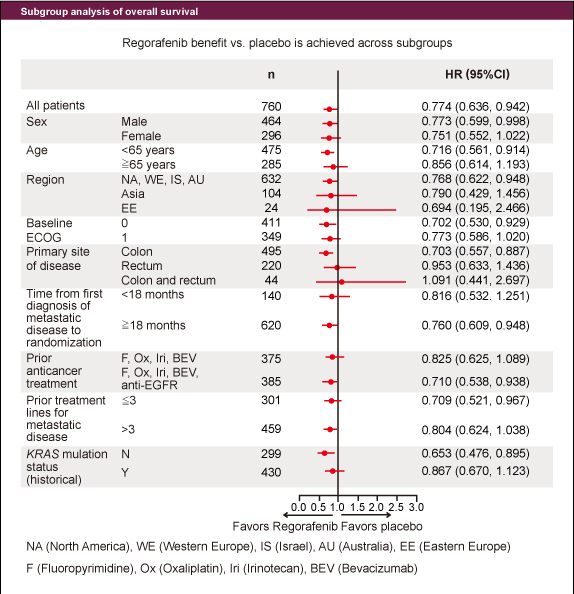 図2
図2KRAS 野生型の症例はRegorafenib群で40.6%、placebo群で36.9%に認め、OS中央値は各々7.3ヵ月、5.0ヵ月 (HR: 0.653) 、PFS中央値は2.0ヵ月、1.8ヵ月 (HR: 0.475) であった。KRAS 変異型の症例におけるOS中央値は各々6.2ヵ月、5.1ヵ月 (HR: 0.867) 、PFS中央値は1.9ヵ月、1.7ヵ月 (HR: 0.525) であった (表) 。
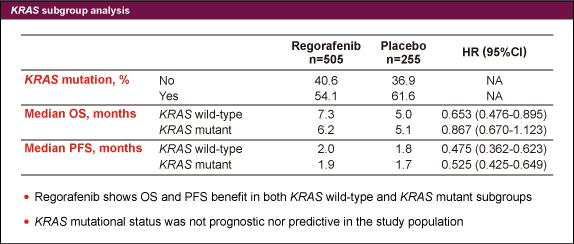
表
Regorafenibに関連したgrade 3以上の主な有害事象は、手足症候群 (16.6%) 、倦怠感 (9.6%) 、高血圧 (7.2%) 、下痢 (7.2%) 、発疹/落屑 (5.8%) であった。両群間でQOLに有意な差は認めなかった。
結論
Regorafenibは切除不能進行・再発大腸癌に対して有効性を示した最初の経口マルチキナーゼ阻害剤であり、標準治療抵抗性例のOS、PFSを有意に改善し、KRAS statusを含んだサブグループ解析においても同様の有効性が示された。副作用も管理可能であり、本薬剤は同対象に対する標準治療になり得るものと思われる。
コメント
Regorafenib (BAY73-4506) は腫瘍の血管新生にかかわるVEGFR、TIE-2を標的にし、さらに腫瘍増殖にかかわるRAFなどにも阻害作用を有するとされる経口マルチキナーゼ阻害剤である。
これまでも、進行・再発大腸癌に対するSunitinibなどの低分子化合物の開発が多数実施されてきたが、OSの延長には結びつかず、negativeな結果に終わっていた。今までの試験では、初回化学療法に拘るものが多く、従来の強力な標準的化学療法との併用による検証が行われた。そのため、副作用が強く出現し減量・休薬の頻度も増え、両薬剤ともに十分量を投与できないために効果も得られず、positive試験になり得なかった。一方、今回のCORRECT試験では、Regorafenibが他の低分子化合物と同様の副作用を有するにも関わらず、OSの明らかな延長を示すことができ、有効中止となった。演者のVan Cutsem氏も述べていたように、進行・再発大腸癌に対して初めて効果が証明された低分子化合物となった。これは、先行した他剤の試験を検証し、多剤耐性となったサルベージラインでの単剤治療という開発戦略を選択したことが功を奏したと考える。Regorafenibは、その効果が評価されるのはもちろんのことであるが、上述のSunitinibなどと同様にhand foot syndromeや倦怠感、高血圧などgrade 3以上の重篤かつ特有の有害事象が生じるため、注意を要する。
独Bayer Healthcare社では、今回の米国臨床腫瘍学会年次集会直前の2012年5月23日に、進行・再発大腸癌の治療薬としてRegorafenibの承認申請を米国食品医薬品局 (FDA) に行ったと発表した。これを機に、世界中で担当官庁への申請が次々に始まり、本邦でも使用可能となる日も近づいてきたと思われる。本試験は日本も参加したGlobal試験であり、実際に筆者も参加する機会を得た。現時点においても、治療効果が持続している患者さんに投与を継続していることから、今回米国臨床腫瘍学会年次集会のメイン会場にてRegorafenibが新しい標準的治療として報告されるのを目前にして、その誕生に関わることができたことを思うと、改めて感慨深い報告となった。
( レポート:山﨑 健太郎 監修・コメント:小松 嘉人 )

