Abstract #4007
切除不能進行膵癌に対するGemcitabine + S-1 vs. S-1単剤 vs. Gemcitabine単剤の日本/台湾共同無作為化比較第III相試験: GEST study
Randomized Phase III study of gemcitabine plus S-1 (GS) versus S-1 versus gemcitabine (Gem) in unresectable advanced pancreatic cancer in Japan and Taiwan: GEST study.
Tatsuya Ioka, et al.

Gemcitabine (GEM) は進行膵癌に対する標準的化学療法として認識されている。また、経口フッ化ピリミジン系抗癌剤であるS-1は、第II相試験においてRR (response rate) 37.5%、OS (overall survival) 中央値9.2ヵ月1)と良好な結果を残し、本邦の膵癌診療において重要な役割を果たす薬剤のひとつとなっている
。
過去にGEMベースの併用療法がGEM単剤と比較されてきたが、大部分の試験では上乗せ効果を示せず、また単剤でGEMに対して非劣性を示した薬剤も存在しない。 しかし、転移を有する膵癌に対する一次治療として、Gemcitabine + S-1(GS) 療法は、第II相試験において、RRが44-48%、OS中央値は10.1-12.5ヵ月と期待できる成績が報告された2,3)。
過去にGEMベースの併用療法がGEM単剤と比較されてきたが、大部分の試験では上乗せ効果を示せず、また単剤でGEMに対して非劣性を示した薬剤も存在しない。 しかし、転移を有する膵癌に対する一次治療として、Gemcitabine + S-1(GS) 療法は、第II相試験において、RRが44-48%、OS中央値は10.1-12.5ヵ月と期待できる成績が報告された2,3)。
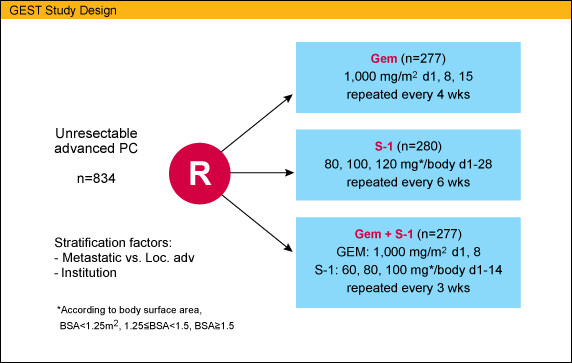
GEST試験はオープンラベル無作為化比較第III相試験である。化学療法未施行のPS 0-1の切除不能進行膵癌で、臓器機能が保たれている症例が対象となり、GEM (1,000mg/m2 day1, 8, 15: 4週毎)、S-1 (体表面積に応じて80/100/120mg/日 day1-28: 6週毎)、GS (GEM 1,000mg/m2 day1, 8; S-1 体表面積に応じて60/80/100mg/日 day1-14: 3週毎) の3群に無作為割付された。
本試験の主要評価項目はOSであり、GEMに対するS-1の非劣性とGEMに対するGSの優越性が検証され、副次評価項目はPFS (progression-free survival)、RR、安全性、QOL (EQ-5D) とされた。また、多重比較試験であり、α=0.0125 (片側) で検出力 90%として症例設定された。GEMに対するS-1の非劣性に関しては、HRの97.5%CIの上限が1.33を超えない場合、非劣性であると結論づけることとした。
本試験の主要評価項目はOSであり、GEMに対するS-1の非劣性とGEMに対するGSの優越性が検証され、副次評価項目はPFS (progression-free survival)、RR、安全性、QOL (EQ-5D) とされた。また、多重比較試験であり、α=0.0125 (片側) で検出力 90%として症例設定された。GEMに対するS-1の非劣性に関しては、HRの97.5%CIの上限が1.33を超えない場合、非劣性であると結論づけることとした。
2007年7月から2009年10月までに日本と台湾から834例が登録され(GEM 277例、S-1 280例、GS 277例)、680以上の死亡イベントが確定してから解析が行われた。
患者背景は各群で大きな差はみられなかった。
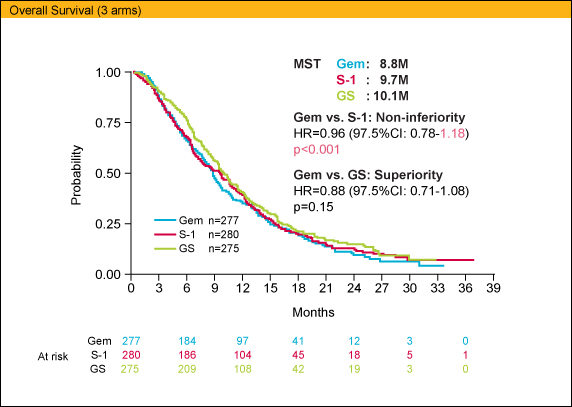
主要評価項目のOSに関しては、各群中央値がGEM 8.8ヵ月、S-1 9.7ヵ月、GS 10.1ヵ月であり、GEMに対するS-1の非劣性が証明された (HR=0.96, 97.5%CI: 0.78-1.18; p<0.001)。しかしながら、GEMに対するGSの比較においては優越性を示すことは出来なかった (HR=0.88, 97.5%CI: 0.71-1.08; p=0.15)。
主要評価項目のOSに関しては、各群中央値がGEM 8.8ヵ月、S-1 9.7ヵ月、GS 10.1ヵ月であり、GEMに対するS-1の非劣性が証明された (HR=0.96, 97.5%CI: 0.78-1.18; p<0.001)。しかしながら、GEMに対するGSの比較においては優越性を示すことは出来なかった (HR=0.88, 97.5%CI: 0.71-1.08; p=0.15)。
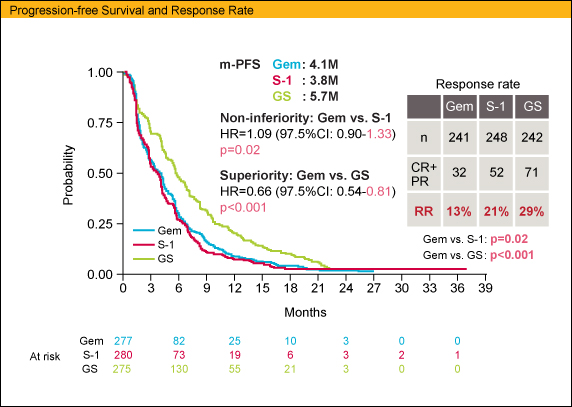
PFSに関しては、各群中央値がGEM 4.1ヵ月、S-1 3.8ヵ月、GS 5.7ヵ月であり、GEMに対するS-1の非劣性 (HR=1.09, 97.5%CI: 0.90-1.33; p=0.02)、GEMに対するGSの優越性 (HR=0.66, 97.5%CI: 0.54-0.81; p<0.001) が示された。RRはGEM 13%、S-1 21%、GS 29%であり、GEMに対してS-1、GSいずれも有意な改善を示した (GEM vs. S-1; p=0.02, GEM vs. GS; p<0.001)。
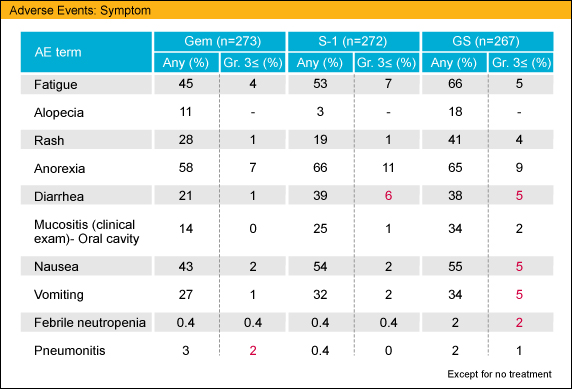
Grade 3以上の有害事象に関しては (GEM/S-1/GS: %)、好中球数減少は41/9/62、血小板数減少は11/2/17とS-1群に比較し、GEM群・GS群で血液毒性が強い傾向があったが、一方、下痢は1/6/5とS-1およびGSのS-1使用群で高い傾向にあった。
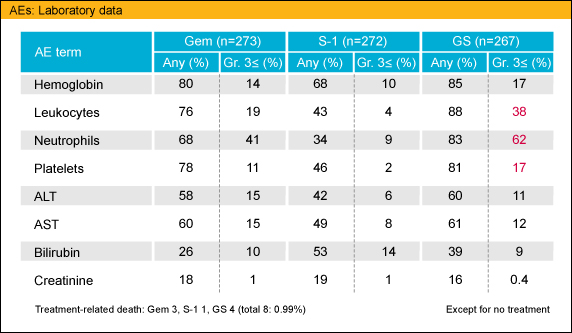
治療終了後の後治療に関しては、GEM 70%、S-1 71%、GS 69%の症例に後治療が行われており、いずれも大きな差を認めなかった。
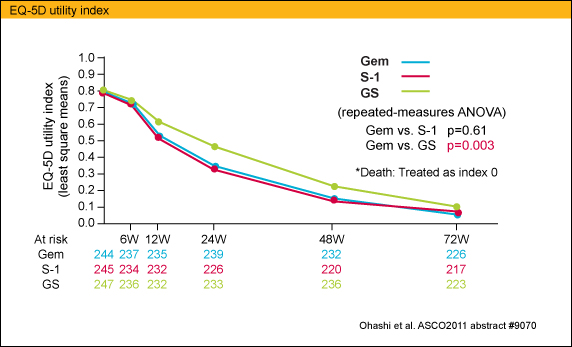
S-1におけるEQ-5D QOLスコアはGEMに近似していたが (p=0.61)、GSはGEMと比較して有意に良好な結果であった (p=0.003)。
S-1におけるEQ-5D QOLスコアはGEMに近似していたが (p=0.61)、GSはGEMと比較して有意に良好な結果であった (p=0.003)。
経口のS-1は膵癌に対する一次治療としてGEMと同様の有効性と安全性を示した。本試験は単剤でGEMに対して非劣性を示した初めての試験である。
また、GSはGEMと比較し、PFSは有意に改善したが、OSに関しては有意差を認めなかった。今回のQOL解析の結果より、GSはGEMよりも良好なQOLをもたらすことを示唆した。
また、GSはGEMと比較し、PFSは有意に改善したが、OSに関しては有意差を認めなかった。今回のQOL解析の結果より、GSはGEMよりも良好なQOLをもたらすことを示唆した。
本報告は、検証目的の第III相臨床試験である。その結果、GEM単剤に対するS-1単剤の非劣性が証明された。同時に、GEM単剤に対するGEM + S-1併用療法の優越性は証明されなかった。この結果を受けて、S-1はGEMと並び、進行膵癌の一次治療の標準治療となった。全世界で行われてきた進行膵癌の抗癌剤開発において、GEMに対する非劣性が証明された薬剤は過去になく、本報告は画期的な結果である。生存期間についても、いずれの治療レジメンにおいてもMSTが9-10ヵ月前後と、膵癌領域における治療成績としては良好である。また、毒性についても、いずれの治療レジメンもgrade 3以上の有害事象が少なく、忍容性に優れている。後治療解析をみると、GEMとS-1の両薬剤が使用されていることより、毒性プロファイルの違い、あるいは経口薬と注射剤という剤型の違い等から、一次治療薬を選択し、治療全過程において両薬剤を使用していくのが現実的な治療戦略かと考える。
ところで、本試験は付随研究としてQOL解析が行われていることに注目されたい。QOLの解析結果は、本年6月4日のGeneral Poster SessionにてOhashiらによって発表された (abstract #9070)。QOL解析では、「EQ-5D utility index (効用値)」と「QALY (生活の質; QOLを調整した生存期間)」の群間比較 (GEM vs. S-1, GEM vs. GS)が行われた。結果はGEM群とS-1群はほぼ同様の推移を示し、群間に有意な違いはなかったが、一方GS群はGEM群と比べて高い値で推移し、群間に有意な違いがみられた (p=0.003)。このことより、S-1群はGEM群に対して、QOLへの悪影響を伴わずに非劣性が検証されたことになり、GS群では優越性は認められないものの、GEM群に比べてより良好なQOLが得られていたことになる。腫瘍縮小等の直接的な治療効果の影響があるのかもしれない。
本報告では、このGS群の解釈に注目したい。OSでGEM群に比較して優越性が認められないので、標準治療にはならない。ただし、PFSの有意な延長に加えて、毒性が高くなる併用療法にも関わらず単剤治療よりも良好なQOLが獲得されるとなると、key drugが2剤しかない膵癌化学療法の領域では、あくまでも個人的な意見だが、やはり選択肢のひとつとして全く否定されるものではないと考えるのである。今後のさらなる研究が必要である。
ところで、本試験は付随研究としてQOL解析が行われていることに注目されたい。QOLの解析結果は、本年6月4日のGeneral Poster SessionにてOhashiらによって発表された (abstract #9070)。QOL解析では、「EQ-5D utility index (効用値)」と「QALY (生活の質; QOLを調整した生存期間)」の群間比較 (GEM vs. S-1, GEM vs. GS)が行われた。結果はGEM群とS-1群はほぼ同様の推移を示し、群間に有意な違いはなかったが、一方GS群はGEM群と比べて高い値で推移し、群間に有意な違いがみられた (p=0.003)。このことより、S-1群はGEM群に対して、QOLへの悪影響を伴わずに非劣性が検証されたことになり、GS群では優越性は認められないものの、GEM群に比べてより良好なQOLが得られていたことになる。腫瘍縮小等の直接的な治療効果の影響があるのかもしれない。
本報告では、このGS群の解釈に注目したい。OSでGEM群に比較して優越性が認められないので、標準治療にはならない。ただし、PFSの有意な延長に加えて、毒性が高くなる併用療法にも関わらず単剤治療よりも良好なQOLが獲得されるとなると、key drugが2剤しかない膵癌化学療法の領域では、あくまでも個人的な意見だが、やはり選択肢のひとつとして全く否定されるものではないと考えるのである。今後のさらなる研究が必要である。
(レポート: 結城 敏志 監修・コメント: 佐藤 温)

このサイトは医療関係者の方々を対象に作成しています。必ずご利用規約に同意の上、ご利用ください。記事内容で取り上げた薬剤の効能・効果および用法・用量には、日本国内で承認されている内容と異なるものが、多分に含まれていますのでご注意ください。
