Abstract #3575
切除不能進行・再発大腸癌に対する1st-lineとしてのFOLFIRI + CetuximabとFOLFIRI + Bevacizumabの比較: German AIO study KRK-0306におけるKRAS 変異型症例の解析
FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first-line treatment for patients with metastatic colorectal cancer (mCRC) : Analysis of patients with KRAS mutated tumors in the randomized German AIO study KRK-0306.
Sebastian Stintzing, et al.

German AIO study KRK-0306は切除不能進行・再発大腸癌の1st-lineにおけるFOLFIRI + CetuximabとFOLFIRI + Bevacizumabの安全性および有効性を比較した無作為化比較第III相試験である。本試験は2008年10月からKRAS 野生型の症例のみが登録されるようになったが、2008年9月まではKRAS 変異の有無にかかわらず症例が登録されていた。
今回は2008年9月以前に登録された症例のうち、KRAS 変異を有する大腸癌症例のサブグループ解析を報告する。
今回は2008年9月以前に登録された症例のうち、KRAS 変異を有する大腸癌症例のサブグループ解析を報告する。
2008年9月までに切除不能進行・再発大腸癌患者336例が下記の2群に無作為割付された。
解析段階で96例 (ITT population) にKRAS 変異が認められた (Arm A: 50例, Arm B: 46例)。
本試験の主要評価項目はresponse rate (RR)であり、副次評価項目はPFS (progression-free survival)、 OS (overall survival)、病勢制御率、忍容性、Grade 3/4の有害事象であった。
| ・Arm A (169例): | FOLFIRI (Irinotecan: 180mg/m2, Folic acid: 400mg/m2, 5-FU bolus 400mg/m2, day 1; 5-FU: 46時間 2,400mg/m2, day 1-2: 2週毎) + Cetuximab (400mg/m2 day 1, 以後250mg/m2で毎週投与) |
| ・Arm B (167例): | FOLFIRI + Bevacizumab (5mg/kg: 2週毎) |
本試験の主要評価項目はresponse rate (RR)であり、副次評価項目はPFS (progression-free survival)、 OS (overall survival)、病勢制御率、忍容性、Grade 3/4の有害事象であった。
追跡期間中央値は21.1ヵ月であった。Arm Aでは、KRAS 変異が判明した段階での早期脱落症例が9例いたため、治療有効性を評価した症例 (最初の腫瘍評価まで治療を継続した症例) はArm Aで41例、Arm Bで46例であった。RRはArm Aで43.9%、Arm Bでは47.8%であり、有意差は認めなかった (p=0.83)。
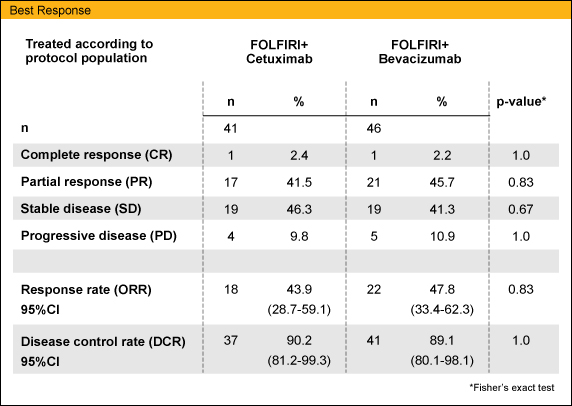
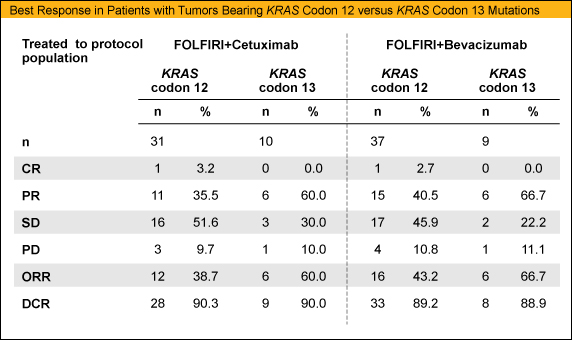
KRAS 変異部位別のRRは、Arm Aでcodon 12: 38.7%、codon 13: 60.0%であったのに対し、Arm Bではcodon 12: 43.2%、codon 13: 66.7%と、いずれもcodon 13変異症例においてRRが高い傾向が示された。
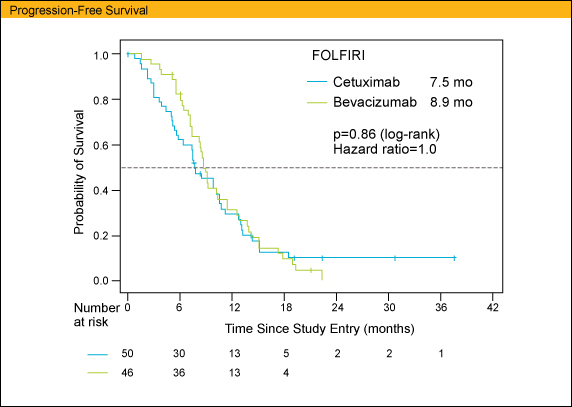
ITT populationにおけるPFS中央値はArm Aで7.5ヵ月、Arm Bで8.9ヵ月であり、両群間に有意差は認めなかった (HR=1.0, p=0.86)。
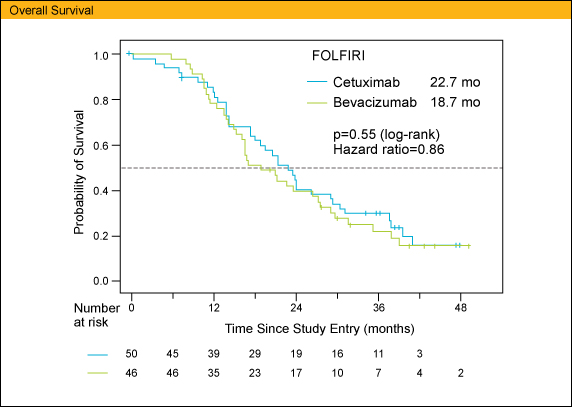
また、OS中央値はArm Aで22.7ヵ月、Arm Bでは18.7ヵ月であり、PFSと同様に両群間で有意差は認めなかった (HR=0.86, p=0.55)。
Grade 3以上の有害事象で高頻度に発現したものは、好中球減少 (Arm A: 28.0% vs. Arm B: 17.4%, p=0.236)、ざ瘡様皮疹 (20.0% vs. 0%; p<0.01)、高血圧 (8.0% vs. 21.7%; p=0.08)、下痢 (6.0% vs. 15.2%; p=0.19)、肝機能障害 (16.0% vs. 10.9%; p=0.56)、血栓塞栓症 (8.0% vs. 17.4%; p=0.22) であった。
投与状況に関して、Arm Aでは全325サイクル中、減量投与されたのが27.4%に対し、Arm Bでは全553サイクル中14.5%であり、Arm Aで有意に減量投与が多かった (p<0.0001)。治療中止事由は、両群とも増悪中止が少なく (Arm A: 24.4%, Arm B: 23.9%)、毒性中止(24.4% vs. 26.1%) や患者希望による中止 (14.6% vs. 23.9%) が多かった。
投与状況に関して、Arm Aでは全325サイクル中、減量投与されたのが27.4%に対し、Arm Bでは全553サイクル中14.5%であり、Arm Aで有意に減量投与が多かった (p<0.0001)。治療中止事由は、両群とも増悪中止が少なく (Arm A: 24.4%, Arm B: 23.9%)、毒性中止(24.4% vs. 26.1%) や患者希望による中止 (14.6% vs. 23.9%) が多かった。
KRAS 変異症例の解析において、FOLFIRIにCetuximabを加えた症例とBevacizumabを加えた症例の有効性に有意な差は認めなかった。
本試験はドイツAIO groupで実施された切除不能進行・再発大腸癌の1st-lineにおけるBevacizumabとCetuximabの有用性を、FOLFIRIをベースに比較・検討したKRK-0306試験のサブグループ解析である。
当時はKRAS 解析の意義が確認されていない時代であったため、Cetuximab投与が行われたKRAS 変異型症例のデータが蓄積されていた。結果的にKRAS 変異型症例に対する BevacizumabとCetuximabの有用性の解析が可能になったのだが、KRAS 解析の意義が明確になった現在、今後は倫理的に計画できない内容である。
結果は大方の予想に反して、KRAS 変異型における BevacizumabとCetuximabに差が認められなかった。Cetuximabに関しては、CRYSTAL試験のサブグループ解析でのKRAS 変異型症例の結果 (FOLFIRI群: PFS 8.1ヵ月,RR 36%; FOLFIRI+Cetuximab群: PFS 7.6ヵ月、RR 40%)1) との差異も認められない。Bevacizumabに関しては、AVF2107g試験のサブグループ解析でのKRAS 変異型症例の結果 (IFL群: OS 13.6ヵ月; IFL+Bevacizumab群: OS 19.9ヵ月)2) と市販後第III相PACCE試験でのサブグループ解析の結果が報告されているのみである。
報告の内容で気になるのは増悪による中止が両群1/4程度と少ない点であるが、両群の背景にも差はなく、報告者への直接の質問でも、両群において2nd-line以降の治療差はないとのことであった。本報告は本来の統計学的根拠に基づかない解析であり、検証結果ではない。ただし、今後はKRAS 変異型症例に対する治療戦略の再検討も必要になるのではないかと考える。
結果は大方の予想に反して、KRAS 変異型における BevacizumabとCetuximabに差が認められなかった。Cetuximabに関しては、CRYSTAL試験のサブグループ解析でのKRAS 変異型症例の結果 (FOLFIRI群: PFS 8.1ヵ月,RR 36%; FOLFIRI+Cetuximab群: PFS 7.6ヵ月、RR 40%)1) との差異も認められない。Bevacizumabに関しては、AVF2107g試験のサブグループ解析でのKRAS 変異型症例の結果 (IFL群: OS 13.6ヵ月; IFL+Bevacizumab群: OS 19.9ヵ月)2) と市販後第III相PACCE試験でのサブグループ解析の結果が報告されているのみである。
報告の内容で気になるのは増悪による中止が両群1/4程度と少ない点であるが、両群の背景にも差はなく、報告者への直接の質問でも、両群において2nd-line以降の治療差はないとのことであった。本報告は本来の統計学的根拠に基づかない解析であり、検証結果ではない。ただし、今後はKRAS 変異型症例に対する治療戦略の再検討も必要になるのではないかと考える。
(レポート: 結城 敏志 監修・コメント: 佐藤 温)

このサイトは医療関係者の方々を対象に作成しています。必ずご利用規約に同意の上、ご利用ください。記事内容で取り上げた薬剤の効能・効果および用法・用量には、日本国内で承認されている内容と異なるものが、多分に含まれていますのでご注意ください。
