 |
|||
|
 |
||
転移を有する結腸・直腸癌に対するFOLFOXIRI療法は、第III相試験において、FOLFIRIに比較して有意にRR、PFS、OS、根治的切除率の改善を示すことが報告されている1)。また、フッ化ピリミジン/oxaliplation/irinotecanベースの3剤併用療法にbevacizumabを併用することの安全性や、有効性の改善が得られる2-4)。
G.O.N.O. グループは、転移を有する結腸・直腸癌に対する一次治療としてのbevacizumab + FOLFOXIRI療法の有用性を検討するために、第II相試験を実施した。
本試験の適格基準・除外基準を以下に示す。
適格基準: |
組織学的に腺癌と診断された症例 |
除外基準: |
bevacizumabの前治療歴のある症例 |
対象患者に、FOLFOXIRI療法(irinotecan 165 mg/m2 day1、oxaliplatin 85 mg/m2 day1、l-LV 200 mg/m2 day1、5FU 3,200 mg/m2 48 h持続静注、day1開始)+bevacizumab (5 mg/kg、day1)による治療を行い、2週毎に繰り返した。
一次エンドポイントは、10ヵ月時点での病状安定率、二次エンドポイントはRR、転移巣に対する根治切除、PFS、OS、安全性、bevacizumabの活性を予測できるマーカーの評価とした。
57例が本試験に登録された。患者背景を以下に示す。
|
|||||||||||||||||||
主な有害事象を以下に示す。現時点で毒性による死亡例は認められていない。
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
現在までに51例で効果が判定された。RRは75%[CR 6例(12%)、PR 32例(63%)]であり、病状安定率は100%であった。
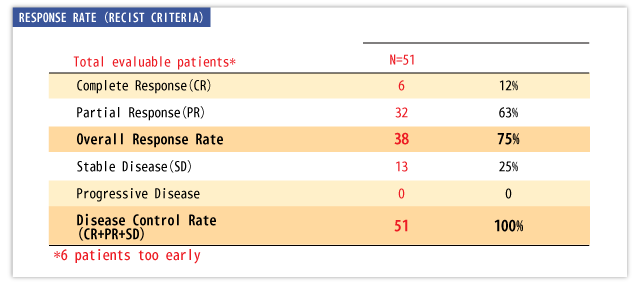
8例(16%)で肝転移に対する2次手術が施行され、根治切除は7例であった。観察期間中央値は7.7ヵ月であり、10ヵ月PFSは73%であった。
FOLFOXIRI療法とbevacizumabの併用は実施可能なレジメンであり、毒性は許容範囲内であった。また、予期せぬ有害事象は認められなかった。本療法の効果は高く(RR=75%、病状安定率=100%、10ヵ月PFS=73%)、転移に対する手術例のPFS、OSはまだ算出できないが、有望であると考えられた。本試験の症例登録は終了したが、現在、フォローアップ中である。G.O.N.Oグループでは、FOLFIRI+bevacizumabとFOFOXIRI+bevacizumabを比較する第III相試験を予定している。
FOLFOXIRIにbevacizumabを併用する治療法である。毒性の増強は全て予測可能な範囲であり、認容性は高いものと思われる。治療効果はまさに驚異的である。勿論、本試験は第II相試験であるので、相当なviasがかかっていることが予測されるが、抗体の併用療法では期待される程の効果が得られないことが報告されていることから、本療法は現時点で転移を有する結腸・直腸癌に対する最強な治療法と位置づけられるものと思われる。今後の第III相試験による安全性と有効性の検証に大いに期待したい。
1) A. Falcone,et al.: J Clin Oncol 25(13):1670, 2007
2) H. Hurwitz,et al.: N Engl J Med 350:2335, 2004
3) BJ. Giantonio,et al.: J Clin Oncol 25(12):1539, 2007
4) LB.Saltz,et al.: J Clin Oncol 26(3):511,2008
レポーター:佐瀬 善一郎 監修:寺島 雅典