ESMO 2014 Congress
膵 癌
Abstract #LBA19
進行再発膵癌患者に対する1st-lineとしてのOncolytic virus、Reolysinの多施設共同第II相試験:最終解析
A Multi-institutional Randomized Phase 2 Trial of the Oncolytic Virus Reolysin in the First Line Treatment Metastatic Adenocarcinoma of the Pancreas (MAP): Final Analysis
T. Bekaii-Saab, et al.
Expert's view

仁科 智裕 先生
国立病院機構
四国がんセンター
消化器内科
本試験で用いられたReovirusはRas経路の活性化された癌細胞に有効性を示すことが報告されており、膵癌において期待されていた。しかし結果を見る限り、本試験で行われた対象においての有効性は乏しいことが示唆されていると思われる。今後は有効性のある対象をバイオマーカーなどで絞り込むことが課題となるであろう。現在、頭頚部癌、非小細胞肺癌、乳癌、大腸癌、前立腺癌、グリオーマ、メラノーマなどでもReovirusの有効性を検証する試験が進行中のようであり、その結果により今後のReovirusのoncolytic viral therapyとしての位置づけが決まるものと思われる。
本試験で検討された化学療法のベースレジメンであるCarboplatin + Paclitaxel療法は、進行再発膵癌における標準治療ではないが、PFS中央値が5ヵ月前後と良好な成績であった。Nab-Paclitaxelの有効性が第III相試験にて証明されているためその位置づけは微妙ではあるが、発表者の結論のように、治療選択肢の少ない進行再発膵癌に対する治療として検討すべきレジメンであることは間違いないであろう。
膵癌に対する標準治療は、過去10年以上にわたりGemcitabine単剤であった。近年になりGemcitabine + nab-Paclitaxel (GA療法) や、一部の症例ではFOLFIRINOXが使用されるようになったが、GA療法によって得られるOS中央値は8.5ヵ月、奏効率は23%程度である。
Reovirusは自然発生ウイルスで、Ras経路が活性化された癌細胞に感染して腫瘍崩壊を引き起こすが、タキサン製剤との併用によりその効果は相乗的に高まると考えられている。多くの膵癌細胞は下流においてRas活性化が起きていることから、進行再発膵癌に対して適応できる可能性がある。プラチナ製剤とタキサン製剤の併用には強い論拠があるため、進行再発膵癌患者に対する1st-lineとしてCarboplatin + Paclitaxel (CP療法) に対する癌治療ウイルスReolysinの上乗せ効果を検討する多施設共同第II相試験を実施した。
Reovirusは自然発生ウイルスで、Ras経路が活性化された癌細胞に感染して腫瘍崩壊を引き起こすが、タキサン製剤との併用によりその効果は相乗的に高まると考えられている。多くの膵癌細胞は下流においてRas活性化が起きていることから、進行再発膵癌に対して適応できる可能性がある。プラチナ製剤とタキサン製剤の併用には強い論拠があるため、進行再発膵癌患者に対する1st-lineとしてCarboplatin + Paclitaxel (CP療法) に対する癌治療ウイルスReolysinの上乗せ効果を検討する多施設共同第II相試験を実施した。
対象は臓器機能を有する化学療法治療歴のない進行再発膵癌患者であり、Carboplatin (AUC 5, day 1) + Paclitaxel (175mg/m2, day 1) + Reolysin (3×1010 TCID50/day, day 1-5) を21日毎に投与する群 (CP + Reolysin群) と、CP療法を行う群 (CP群) に1:1で無作為に割り付けた。なお、CP群で病勢進行を認めた場合にはReolysin併用へのクロスオーバーを許可した。
主要評価項目はPFS、副次評価項目は奏効率、OS、毒性および忍容性であり、探索的解析としてKRAS 変異解析、免疫学的バイオマーカーおよびコスト解析を行った。コスト解析ではMedicareの平均売価および病院・医師への償還率を用いて、各月の薬剤コストを算出した。PFS中央値が3ヵ月から5.5ヵ月に改善すると仮定し、片側α=0.20、検出力90%で、必要症例数は70例であった。
主要評価項目はPFS、副次評価項目は奏効率、OS、毒性および忍容性であり、探索的解析としてKRAS 変異解析、免疫学的バイオマーカーおよびコスト解析を行った。コスト解析ではMedicareの平均売価および病院・医師への償還率を用いて、各月の薬剤コストを算出した。PFS中央値が3ヵ月から5.5ヵ月に改善すると仮定し、片側α=0.20、検出力90%で、必要症例数は70例であった。
2011年2月から2014年4月の間に76例が無作為化されたが、3例が治療を受けなかったため、CP + Reolysin群36例、CP群37例であった。なお、両群の患者背景は同等であった。
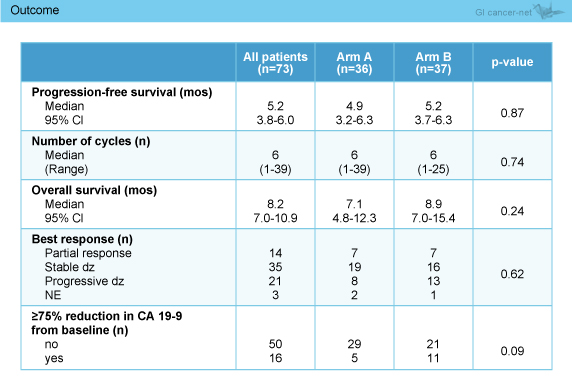
PFS中央値はCP + Reolysin群4.9ヵ月、CP群5.2ヵ月であり、両群間に有意差は認められなかった (p=0.87) (図1)。この結果は感度分析およびKRAS などの因子による調整後も同様であった。KRAS 解析は60例で行われたが、PFSはKRAS 野生型5.6ヵ月、変異型4.9ヵ月と差は認められなかった (p=0.64)。
また、OSや奏効率などについても両群間に有意な差はなかった (表1)。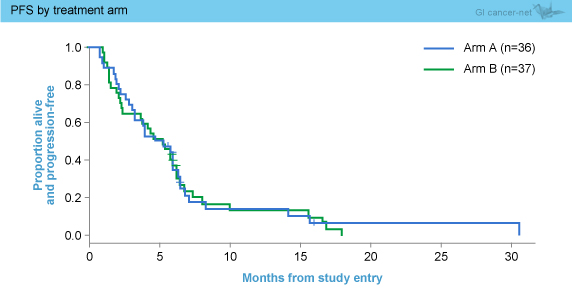
 2nd-lineはCP + Reolysin群12例、CP群4例で行われた。また、CP群15例でクロスオーバーが行われ、クロスオーバー症例における抗腫瘍効果はPR 1例、SD 6例、PD 6例、NE 2例で、PFS中央値は1.68ヵ月 (95% CI: 1.4-NR) であった。
2nd-lineはCP + Reolysin群12例、CP群4例で行われた。また、CP群15例でクロスオーバーが行われ、クロスオーバー症例における抗腫瘍効果はPR 1例、SD 6例、PD 6例、NE 2例で、PFS中央値は1.68ヵ月 (95% CI: 1.4-NR) であった。
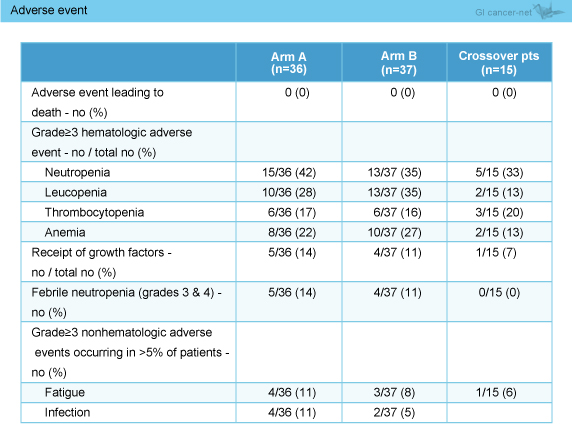
主な有害事象の発現率は両群で同等であり、grade 3以上の発熱性好中球減少症は、CP + Reolysin群14%、CP群11%に認められた (表2)。
 コスト解析の結果、1ヵ月あたりの費用総額はCP療法で427.55USドル、GA療法で9,529.53USドルであった。治療サイクル数中央値を6サイクルであると仮定すると、平均コスト差は患者1人あたり54,611.88USドルと推定された。
コスト解析の結果、1ヵ月あたりの費用総額はCP療法で427.55USドル、GA療法で9,529.53USドルであった。治療サイクル数中央値を6サイクルであると仮定すると、平均コスト差は患者1人あたり54,611.88USドルと推定された。
PFS中央値はCP + Reolysin群4.9ヵ月、CP群5.2ヵ月であり、両群間に有意差は認められなかった (p=0.87) (図1)。この結果は感度分析およびKRAS などの因子による調整後も同様であった。KRAS 解析は60例で行われたが、PFSはKRAS 野生型5.6ヵ月、変異型4.9ヵ月と差は認められなかった (p=0.64)。
また、OSや奏効率などについても両群間に有意な差はなかった (表1)。
図1

表1

主な有害事象の発現率は両群で同等であり、grade 3以上の発熱性好中球減少症は、CP + Reolysin群14%、CP群11%に認められた (表2)。
表2

進行再発膵癌患者に対するCP + Reolysin療法は安全に施行できることが明らかとなった。CP療法に対するReolysinによる上乗せ効果は認められなかったが、両群とも現在の標準治療であるGA療法と同等の成績が得られた。本試験は進行再発膵癌におけるCP療法を検討した最初の報告であり、予想以上の抗腫瘍効果がみられたことから、肺癌や乳癌のように、進行再発膵癌においても比較的安価なタキサン製剤が治療選択肢になることが示唆された。
このサイトは医療関係者の方々を対象に作成しています。必ずご利用規約に同意の上、ご利用ください。記事内容で取り上げた薬剤の効能・効果および用法・用量には、日本国内で承認されている内容と異なるものが、多分に含まれていますのでご注意ください。

