ESMO 2014 Congress
肝細胞癌
Abstract #LBA17
抗血管新生療法歴のある肝細胞癌患者に対するAxitinib + BSCとプラセボ + BSCの無作為化試験
Randomised Study of Axitinib plus Best Supportive Care (BSC) versus Placebo plus BSC in Patients with Advanced Hepatocellular Carcinoma Following Prior Antiangiogenic Therapy
Yoon-Koo Kang, et al.

Expert's view

岩本 慈能 先生
関西医科大学附属
枚方病院
消化管外科
AxitinibはAXIS試験において腎細胞癌の2nd-lineとして有効性が示されているが1)、本試験の主要評価項目であるOSは残念ながらプラセボ群に対するAxitinib群の優越性は証明されなかった。その理由として、治療期間や相対的薬物容量を検証する必要はあるが、Axitinibによる下痢、高血圧、手足症候群などの毒性により治療の延期・中断を余儀なくされた結果と考えられる。
本試験で注目すべき点は、肝細胞癌に対する1st-lineとしての有効性を検証したSHARP試験2)やAsia-Pacific試験3)では見られなかった、地域による効果の違いを認めたことである。アジア人では効果を認めたものの非アジア人では生存曲線がまったく重なっており、このことが有効性に影響を与えたことが考えられる。肝細胞癌は背景肝の肝炎に対する治療を行いながら治療を継続させるという困難性があり、地域間での肝炎に対する治療法やさまざまなサブタイプが混在することによって、このような地域差が生じたと考えられる。
進行肝細胞癌では、マルチキナーゼ阻害剤Sorafenibがプラセボに対してOSの延長効果を認め1, 2)、標準治療として使用されているが、他の分子標的薬は生存ベネフィットを認めていない3-7)。
Axitinibは血管内皮細胞増殖因子 (VEGF) 受容体であるVEGFR-1、VEGFR-2、VEGFR-3の選択的な阻害剤であり、腎細胞癌の2nd-lineとして使用されている。また、進行肝細胞癌の2nd-lineとしてのAxitinibにおける第II相試験では、その有効性が示唆されている。そこで、既治療の進行肝細胞癌に対するAxitinibの有用性を評価するプラセボ対照無作為化試験を行った。
Axitinibは血管内皮細胞増殖因子 (VEGF) 受容体であるVEGFR-1、VEGFR-2、VEGFR-3の選択的な阻害剤であり、腎細胞癌の2nd-lineとして使用されている。また、進行肝細胞癌の2nd-lineとしてのAxitinibにおける第II相試験では、その有効性が示唆されている。そこで、既治療の進行肝細胞癌に対するAxitinibの有用性を評価するプラセボ対照無作為化試験を行った。
対象は、ECOG PS 0/1で1回の血管新生阻害剤治療歴のある局所進行または転移を有する肝細胞癌患者であり、腫瘍浸潤 (腫瘍血管浸潤もしくは肝外進展) の有無および地域 (アジア、非アジア) で層別化し、Axitinib (5mg, 1日2回経口投与) + BSC (best supportive care) を行う群 (Axitinib群) またはプラセボ + BSCを行う群 (プラセボ群) に2:1の割合で無作為に割り付けた。
主要評価項目はOSで、副次評価項目はPFS、奏効率、病勢コントロール率、安全性などであった。OSのハザード比0.60 (中央値で5.0ヵ月から8.3ヵ月への延長) に対応する67%の改善を検出するため、検出力80%、片側α=0.025で最終解析の必要イベント数は150であり、必要登録数は198例であった。
主要評価項目はOSで、副次評価項目はPFS、奏効率、病勢コントロール率、安全性などであった。OSのハザード比0.60 (中央値で5.0ヵ月から8.3ヵ月への延長) に対応する67%の改善を検出するため、検出力80%、片側α=0.025で最終解析の必要イベント数は150であり、必要登録数は198例であった。
2010年12月〜2012年7月の間に202例が登録され、Axitinib群134例、プラセボ群68例に割り付けられた。年齢中央値はそれぞれ61歳、63歳、アジア人は63%、62%、腫瘍浸潤ありは76%、76%であり、他の患者背景もバランスがとれていた。
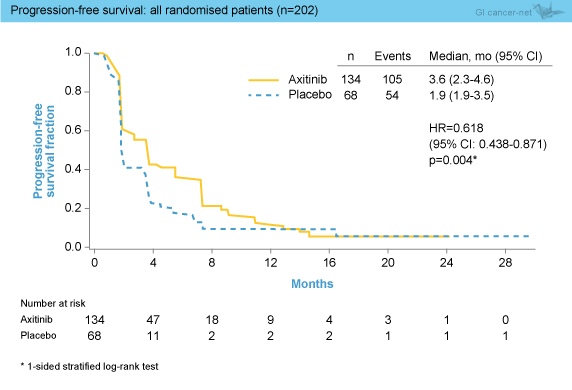
OS中央値はAxitinib群12.7ヵ月、プラセボ群9.7ヵ月で、両群間に有意差は認めなかった (HR=0.870, 95% CI: 0.620-1.222, p=0.211) (図1)。OSのサブグループ解析では、PS 1の症例においてAxitinib群が有意に良好であったが (HR=0.585, 95% CI: 0.359-0.954)、他はいずれも両群間に差はみられなかった。地域別の解析では、アジア人ではAxitinib群で良好な傾向にあったものの有意な差はなく (中央値13.5 vs. 6.3ヵ月, HR=0.809, 95% CI: 0.524-1.249, p=0.170)、非アジア人では両群でほぼ同等であった (中央値12.3 vs. 11.2ヵ月, HR=0.971, 95% CI: 0.565-1.669, p=0.456)。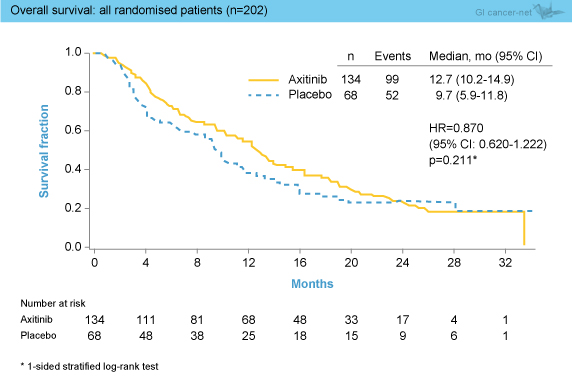 PFS中央値はAxitinib群3.6ヵ月、プラセボ群1.9ヵ月であり、Axitinib群で有意な延長を認めた (HR=0.618, 95% CI: 0.438-0.871, p=0.004) (図2)。なお、地域別の解析では、アジア人では有意な延長を認めたものの (中央値3.6 vs. 1.8ヵ月, HR=0.527, 95% CI: 0.348-0.799, p=0.002)、非アジア人では有意差を認めなかった (中央値3.7 vs. 3.6ヵ月, HR=0.845, 95% CI: 0.464-1.540, p=0.298)。
PFS中央値はAxitinib群3.6ヵ月、プラセボ群1.9ヵ月であり、Axitinib群で有意な延長を認めた (HR=0.618, 95% CI: 0.438-0.871, p=0.004) (図2)。なお、地域別の解析では、アジア人では有意な延長を認めたものの (中央値3.6 vs. 1.8ヵ月, HR=0.527, 95% CI: 0.348-0.799, p=0.002)、非アジア人では有意差を認めなかった (中央値3.7 vs. 3.6ヵ月, HR=0.845, 95% CI: 0.464-1.540, p=0.298)。
 RECIST 1.1による抗腫瘍効果の検討では、奏効率はAxitinib群9.7%、プラセボ群2.9%で (p=0.083)、Axitinib群の1例でCRを認めた。病勢コントロール率はAxitinib群31.1%、プラセボ群11.8%であり、Axitinib群で有意に良好であった (p=0.002)。
RECIST 1.1による抗腫瘍効果の検討では、奏効率はAxitinib群9.7%、プラセボ群2.9%で (p=0.083)、Axitinib群の1例でCRを認めた。病勢コントロール率はAxitinib群31.1%、プラセボ群11.8%であり、Axitinib群で有意に良好であった (p=0.002)。
有害事象は、重篤な有害事象 (47 vs. 24%)、grade 3以上の有害事象 (82 vs. 38%)、有害事象による治療中止 (29 vs. 15%) などはAxitinib群で多くみられた。Axitinib群で頻度の高い有害事象としては、下痢、高血圧、食欲減退、疲労、腹痛、手足症候群、体重減少、悪心などが認められた (表)。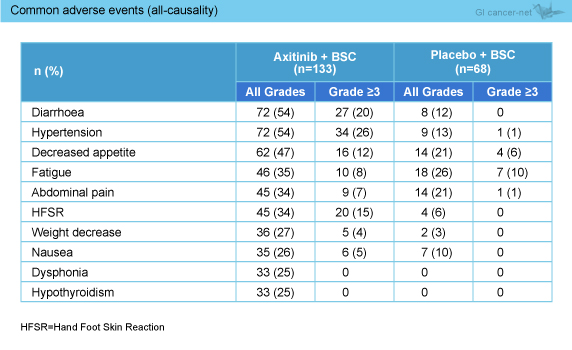
OS中央値はAxitinib群12.7ヵ月、プラセボ群9.7ヵ月で、両群間に有意差は認めなかった (HR=0.870, 95% CI: 0.620-1.222, p=0.211) (図1)。OSのサブグループ解析では、PS 1の症例においてAxitinib群が有意に良好であったが (HR=0.585, 95% CI: 0.359-0.954)、他はいずれも両群間に差はみられなかった。地域別の解析では、アジア人ではAxitinib群で良好な傾向にあったものの有意な差はなく (中央値13.5 vs. 6.3ヵ月, HR=0.809, 95% CI: 0.524-1.249, p=0.170)、非アジア人では両群でほぼ同等であった (中央値12.3 vs. 11.2ヵ月, HR=0.971, 95% CI: 0.565-1.669, p=0.456)。
図1

図2

有害事象は、重篤な有害事象 (47 vs. 24%)、grade 3以上の有害事象 (82 vs. 38%)、有害事象による治療中止 (29 vs. 15%) などはAxitinib群で多くみられた。Axitinib群で頻度の高い有害事象としては、下痢、高血圧、食欲減退、疲労、腹痛、手足症候群、体重減少、悪心などが認められた (表)。
表

Axitinib + BSC群はプラセボ + BSC群に対し、主要評価項目であるOSの有意な改善は認めなかったが、副次評価項目であるPFSおよび病勢コントロール率では有意な改善を認めた。地域差は顕著であり、アジア人ではOSで良好な傾向を示し、PFSは有意な改善を認めたが、非アジア人ではいずれも有効性を示さなかった。また、安全性プロファイルは既報と一致しており、新たな毒性の徴候はみられなかった。
1) Llovet JM, et al.: N Engl J Med. 359(4): 378-390, 2008 [PubMed]
2) Cheng AL, et al.: Lancet Oncol. 10(1): 25-34, 2009 [PubMed]
3) Cheng AL, et al.: J Clin Oncol. 31(32): 4067-4075, 2013 [PubMed]
4) Johnson PJ, et al.: J Clin Oncol. 31(28): 3517-3524, 2013 [PubMed]
5) Calnap C, et al.: J Clin Oncol. 31(Suppl 4): abstr 249, 2013
6) Llovet JM, et al.: J Clin Oncol. 31(28): 3509-3516, 2013 [PubMed]
7) Zhu AX, et al.: JAMA. 312(1): 57-67, 2014 [PubMed]
2) Cheng AL, et al.: Lancet Oncol. 10(1): 25-34, 2009 [PubMed]
3) Cheng AL, et al.: J Clin Oncol. 31(32): 4067-4075, 2013 [PubMed]
4) Johnson PJ, et al.: J Clin Oncol. 31(28): 3517-3524, 2013 [PubMed]
5) Calnap C, et al.: J Clin Oncol. 31(Suppl 4): abstr 249, 2013
6) Llovet JM, et al.: J Clin Oncol. 31(28): 3509-3516, 2013 [PubMed]
7) Zhu AX, et al.: JAMA. 312(1): 57-67, 2014 [PubMed]
このサイトは医療関係者の方々を対象に作成しています。必ずご利用規約に同意の上、ご利用ください。記事内容で取り上げた薬剤の効能・効果および用法・用量には、日本国内で承認されている内容と異なるものが、多分に含まれていますのでご注意ください。

