ESMO 2014 Congress
大腸癌
Abstract #499O
KRAS 野生型の切除不能進行・再発大腸癌に対する1st-lineにおけるmFOLFOX6 + Cetuximab (8サイクル) 後の維持療法としてのmFOLFOX6 + Cetuximab vs. Cetuximab単剤の第II相試験:MACRO-2試験
Phase II Study of First-line mFOLFOX plus Cetuximab (C) for 8 Cycles Followed by mFOLFOX plus C or Single Agent (s/a) C as Maintenance Therapy in Patients (p) with KRAS Wild Type Metastatic Colorectal Cancer (mCRC): the MACRO-2 Trial
P. Garcia Alfonso, et al.

Expert's view

篠崎 英司 先生
がん研有明病院
消化器内科・
化学療法科
一方、本試験では臨床仮説に基づいた統計的な判断基準はクリアし、単剤維持療法の非劣性が示唆されたと結論づけているのだが、いくつかデザイン上の問題があるように思われる。まず第II相試験で非劣性を検討する妥当性であるが、一般的なデザインではないように思われる。それも、9ヵ月におけるPFSの差の仮定が探索的としても最大15%と大きく、にわかに許容しがたい。結果的にPFS中央値は統計的な有意差はないが単剤維持療法群で短い傾向がみられ、検出力を考慮するとOSに差がないと結論づけることは困難であり、白黒をつけるにはやはり第III相試験が必須と言える。したがって、本試験の結果をもってCetuximab単剤による維持療法を標準的に推奨することは困難であり、今後の検証的試験が必要と言える。さらに本試験では維持療法において単剤以外のFL併用などの選択は示されず、Cetuximab併用治療での最適な維持療法は何かという臨床的課題は解決されない。実臨床においてはCOIN-B試験と合わせて5-FU併用の毒性が許容されない場合に単剤維持療法を許容する根拠にはなるかもしれない。
切除不能進行・再発大腸癌に対する化学療法の多くは緩和的に用いられ、投与期間を延ばすことが必要とされるが、病勢コントロールのために病勢進行もしくは不忍容な有害事象が発現するまで治療を継続すべきであるという明確なエビデンスは存在しない。一方、Oxaliplatin (L-OHP) ベースレジメンでは病勢進行以外の理由で治療を早期に中止する症例が多くみられ、効果を維持しながら患者のQOLを高めることが重要である。
そこで、切除不能進行・再発大腸癌に対する1st-lineにおけるmFOLFOX6 + Cetuximab (Cmab) 療法後の維持療法としてのmFOLFOX6 + Cmab療法とCmab単剤療法を比較する多施設共同無作為化第II相試験、MACRO-2試験が実施された。
そこで、切除不能進行・再発大腸癌に対する1st-lineにおけるmFOLFOX6 + Cetuximab (Cmab) 療法後の維持療法としてのmFOLFOX6 + Cmab療法とCmab単剤療法を比較する多施設共同無作為化第II相試験、MACRO-2試験が実施された。
対象は未治療でECOG PS 2以下のKRAS exon 2野生型切除不能進行・再発大腸癌患者で、mFOLFOX6 (2週毎) + Cmab (250mg/m2, 毎週) 療法を8サイクル投与後、維持療法としてCmab単剤を投与する群とmFOLFOX6 + Cmabを投与する群に2:1で無作為に割り付け、病勢進行まで継続投与した (図1)。本試験の目的は9ヵ月 PFSにおける非劣勢を検証することであり、mFOLFOX6 + Cmab群の9ヵ月PFSを47%、Cmab群における最大差を15%と仮定し、α=0.1、検出力80%で、必要症例数は192例 (Cmab群128例、mFOLFOX6 + Cmab群64例) であった。
なお、主要評価項目は9ヵ月PFS、副次評価項目はPFS、OS、奏効率、R0切除率、治療効果予測としての低マグネシウム血症評価、血中循環腫瘍細胞数、安全性であった。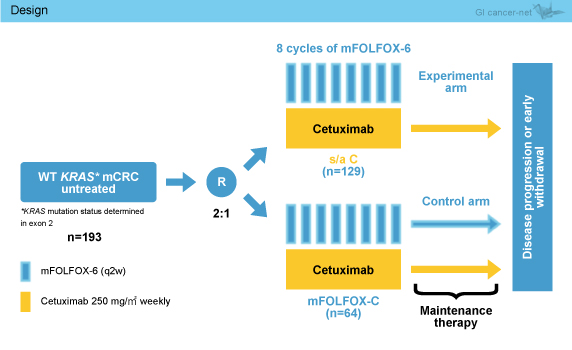
なお、主要評価項目は9ヵ月PFS、副次評価項目はPFS、OS、奏効率、R0切除率、治療効果予測としての低マグネシウム血症評価、血中循環腫瘍細胞数、安全性であった。
図1

対象の193例が、Cmab群129例、mFOLFOX6 + Cmab群64例に割り付けられ、両群の患者背景は同等であった。追跡期間中央値13.9ヵ月 (範囲: 0-38) において、主要評価項目である9ヵ月PFSはCmab群63.6%、mFOLFOX6 + Cmab群71.9%で、両群に有意差は認められなかった (OR=0.6827, 95% CI: 0.3556-1.3108, p=0.25)。
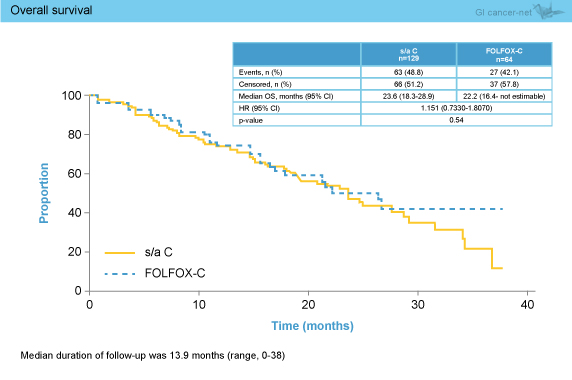
副次評価項目のPFSは中央値がCmab群8.9ヵ月、mFOLFOX6 + Cmab群9.8ヵ月であり有意差を認められなかった (HR=0.690, 95% CI: 0.4498-1.0580, p=0.09) (図2)。同様に、OS (中央値23.6ヵ月 vs. 22.2ヵ月, HR=1.151, 95% CI: 0.7330-1.8070, p=0.54) (図3)、奏効率 (46.5% vs. 39.1%、OR=1.3565, 95% CI: 0.7372-2.4961, p=0.33) についても両群間に有意差は認められなかった。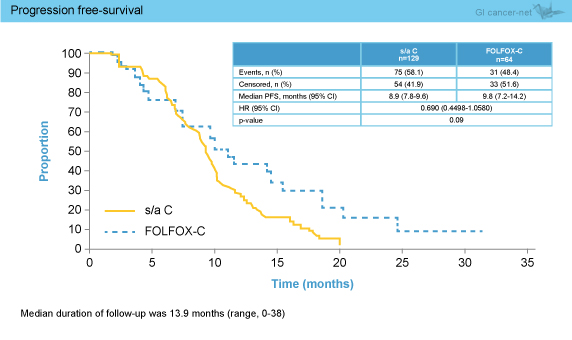
 導入療法の施行サイクル中央値は両群とも8サイクルであり (範囲:1-8)、維持療法はCmab群7サイクル (範囲:1-69)、mFOLFOX6+Cmab群5サイクル (範囲:1-20) であった。なお、維持療法へはCmab群の57.5%、mFOLFOX6+Cmab群の48.4%が移行した。また、治療中止理由は病勢進行がCmab群48.8%、mFOLFOX6+Cmab群30.0%であり、有害事象がそれぞれ23.6%、26.7%、手術が16.3%、25.0%、担当医選択が4.1%、0%、患者選択が0.8%、11.7%であった。
導入療法の施行サイクル中央値は両群とも8サイクルであり (範囲:1-8)、維持療法はCmab群7サイクル (範囲:1-69)、mFOLFOX6+Cmab群5サイクル (範囲:1-20) であった。なお、維持療法へはCmab群の57.5%、mFOLFOX6+Cmab群の48.4%が移行した。また、治療中止理由は病勢進行がCmab群48.8%、mFOLFOX6+Cmab群30.0%であり、有害事象がそれぞれ23.6%、26.7%、手術が16.3%、25.0%、担当医選択が4.1%、0%、患者選択が0.8%、11.7%であった。
L-OHPを減量/延期した治療サイクルの割合はCmab群17.7%、mFOLFOX6 + Cmab群30.8%とmFOLFOX6 + Cmab群で多く、L-OHPの平均累積投与量はCmab群543.9mg/m2、mFOLFOX6+Cmab群645.3mg/m2であった。また、5-FUの平均累積投与量はCmab群15,300.6mg/m2、mFOLFOX6 + Cmab群21,213.7mg/m2とmFOLFOX6 + Cmab群で多かったが、Cmabの平均累積投与量はCmab群5,779.8mg/m2、mFOLFOX6 + Cmab群4,421.5mg/m2とCmab群で多かった。なお、2nd-lineはCmab群の73.2%、mFOLFOX6+Cmab群の67.7%で行われた。
治療に関連したgrade 3/4の有害事象はCmab群61.4%、mFOLFOX6 + Cmab群59.7%に認められた。Cmab群はmFOLFOX6 + Cmab群に比べ末梢神経障害の発現率が有意に低かったが (1.6% vs. 14.5%, p<0.001)、他の有害事象において両群間に有意差は認められなかった (表)。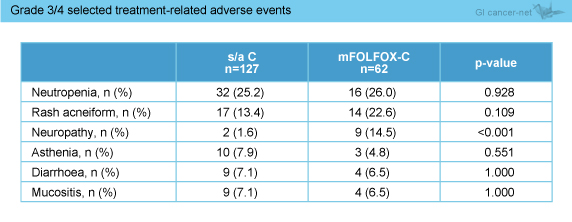
副次評価項目のPFSは中央値がCmab群8.9ヵ月、mFOLFOX6 + Cmab群9.8ヵ月であり有意差を認められなかった (HR=0.690, 95% CI: 0.4498-1.0580, p=0.09) (図2)。同様に、OS (中央値23.6ヵ月 vs. 22.2ヵ月, HR=1.151, 95% CI: 0.7330-1.8070, p=0.54) (図3)、奏効率 (46.5% vs. 39.1%、OR=1.3565, 95% CI: 0.7372-2.4961, p=0.33) についても両群間に有意差は認められなかった。
図2

図3

L-OHPを減量/延期した治療サイクルの割合はCmab群17.7%、mFOLFOX6 + Cmab群30.8%とmFOLFOX6 + Cmab群で多く、L-OHPの平均累積投与量はCmab群543.9mg/m2、mFOLFOX6+Cmab群645.3mg/m2であった。また、5-FUの平均累積投与量はCmab群15,300.6mg/m2、mFOLFOX6 + Cmab群21,213.7mg/m2とmFOLFOX6 + Cmab群で多かったが、Cmabの平均累積投与量はCmab群5,779.8mg/m2、mFOLFOX6 + Cmab群4,421.5mg/m2とCmab群で多かった。なお、2nd-lineはCmab群の73.2%、mFOLFOX6+Cmab群の67.7%で行われた。
治療に関連したgrade 3/4の有害事象はCmab群61.4%、mFOLFOX6 + Cmab群59.7%に認められた。Cmab群はmFOLFOX6 + Cmab群に比べ末梢神経障害の発現率が有意に低かったが (1.6% vs. 14.5%, p<0.001)、他の有害事象において両群間に有意差は認められなかった (表)。
表

1st-lineにおけるmFOLFOX6 + Cmab療法に続くCmab単剤による維持療法はmFOLFOX6 + Cmab療法による維持療法に対し非劣性であることが示唆され、今後、第III相試験での検討が必要であると考えられる。現在、RAS statusやR0切除率、効果予測因子としての低マグネシウム血症、血中循環腫瘍細胞数に関する解析を行っている。
1) Wasan H, et al.: Lancet Oncol. 15(6): 631-639, 2014 [PubMed]
このサイトは医療関係者の方々を対象に作成しています。必ずご利用規約に同意の上、ご利用ください。記事内容で取り上げた薬剤の効能・効果および用法・用量には、日本国内で承認されている内容と異なるものが、多分に含まれていますのでご注意ください。

