ESMO 2014 Congress
大腸癌
Abstract #209P
大腸癌における全RAS 変異解析用新規マルチプレックス検査キットの臨床的検証:多施設共同前向き試験、RASKET試験の結果
Clinical Validation of a Novel Multiplex Kit for all RAS Mutations in Colorectal Cancer: Results of RASKET (RAS KEy Testing) Prospective Multicenter Study
Kensei Yamaguchi, et al.

Expert's view

篠崎 英司 先生
がん研有明病院
消化器内科・
化学療法科
今回、比較対照となっているダイレクトシークエンス法は塩基配列から変異を同定する方法で、塩基置換だけでなく欠失や挿入などの変異も検出される。その点でgolden standardの検査法と言えるが、比較的感度が低く必要なDNA量が多いこと、multiplexやhigh throughputが難しい、アナログで解析しなければならないなどの問題点がある。一方、Scorpion-ARMS法はLuminex法同様にallele specificで、本邦で使用されているKRAS exon 2を検出するキットとしては最も感度が高い。主要評価項目である全症例を対象とした新キットとreferenceとのconcordance、また副次評価項目であるKRAS exon 2野生型における新キットとダイレクトシークエンス法のconcordanceともに高い一致率が示された。Allele specificゆえにKRAS A59Eなど用意されていないプローブの変異は検出されなかったが、現在の臨床データや頻度などを考えると実際の臨床上の影響はないと言える。臨床試験では世界標準になりつつあるBEAMing法や他分子もsequence可能なCancer Panelが本キットのライバルと言えるが、コストの面でかなり有利なようだ。今後、早期に体外診断薬として認可され実臨床で使用されることが待たれる。
切除不能進行・再発大腸癌の治療においては、抗EGFR抗体薬の投与開始前にKRAS exon 2 (codon 12, 13) の遺伝子変異を検査することが標準治療になっている。しかし、それ以外のKRAS、NRAS の頻度の低いcodonの変異も抗EGFR抗体薬の効果予測指標となることが報告されている1-3)。
KRAS 遺伝子検査は現在、手動でのマイクロダイセクション (MMD) を伴うダイレクトシークエンス法が広く使用されているが、すべてのRAS 変異を同時かつ迅速に検出できる品質管理された診断キットが望まれる。
そこで、我々が開発したRAS 変異検査用のマルチプレックス検査キット (MEBGEN™ RASKET KIT) の性能を評価するため、ダイレクトシークエンス法およびTheraScreen®KRAS 遺伝子変異検査キットと比較した。
KRAS 遺伝子検査は現在、手動でのマイクロダイセクション (MMD) を伴うダイレクトシークエンス法が広く使用されているが、すべてのRAS 変異を同時かつ迅速に検出できる品質管理された診断キットが望まれる。
そこで、我々が開発したRAS 変異検査用のマルチプレックス検査キット (MEBGEN™ RASKET KIT) の性能を評価するため、ダイレクトシークエンス法およびTheraScreen®KRAS 遺伝子変異検査キットと比較した。
MEBGEN™ RASKET KITはLuminex法を応用した新規のマルチプレックス検査キットである。ホルマリン固定パラフィン包埋 (FFPE) 組織由来のDNA断片をビオチン標識したプライマーを用いてPCR反応によって増幅させ、蛍光ビーズでハイブリダイズさせる。その後、ビーズ・PCR増幅産物複合体を解析し、専用ソフトウェアにより判定する。50〜100ngのDNAを用いた単回反応でPRIME試験1)で報告されている48のRAS 変異すべてが測定可能であり、測定時間は96サンプルセットにつき4.5時間である。
主要評価項目は、レファレンス法 (ダイレクトシークエンス法およびTheraScreen®KRAS 遺伝子変異検査キット) とのKRAS /NRAS exon 2, 3, 4変異の一致率であり、副次評価項目は、KRAS exon 2野生型患者におけるminor RAS 変異 (KRAS exon 3, 4およびNRAS exon 2, 3, 4変異) の一致率、RAS 変異型患者における検査の正確性であった (図1)。一致率の95%信頼区間下限を93%としたところ、必要サンプル数は278例であった。
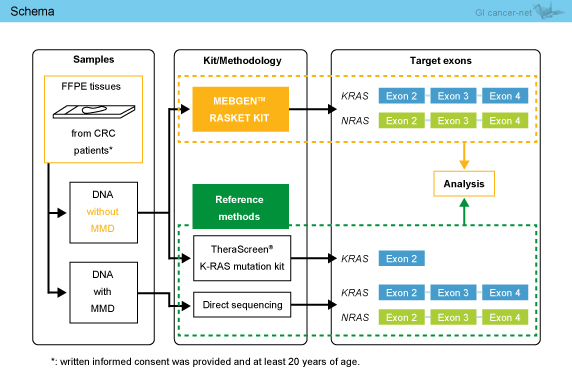
主要評価項目は、レファレンス法 (ダイレクトシークエンス法およびTheraScreen®KRAS 遺伝子変異検査キット) とのKRAS /NRAS exon 2, 3, 4変異の一致率であり、副次評価項目は、KRAS exon 2野生型患者におけるminor RAS 変異 (KRAS exon 3, 4およびNRAS exon 2, 3, 4変異) の一致率、RAS 変異型患者における検査の正確性であった (図1)。一致率の95%信頼区間下限を93%としたところ、必要サンプル数は278例であった。
図1

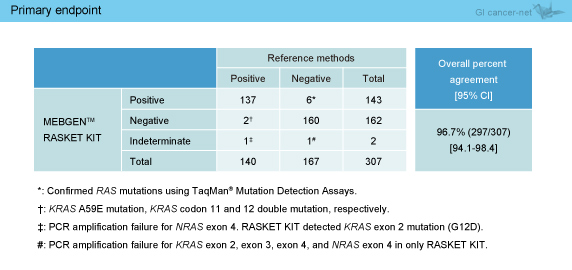
大腸癌患者309例のサンプルが登録され、307例のFFPEサンプルが解析可能であった。RAS 変異はレファレンス法では140サンプル (46%)、MEBGEN™ RASKET KITでは143サンプル (47%) で検出され、一致率は96.7% (95% CI: 94.1-98.4%) であった (表1)。
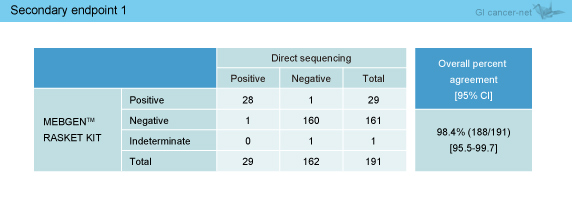
 KRAS exon 2野生型191例におけるminor RAS 変異は、ダイレクトシークエンス法、MEBGEN™ RASKET KITともに29サンプル (15%) で検出され、一致率は98.4% (95% CI: 95.5-99.7%) であった (表2)。
KRAS exon 2野生型191例におけるminor RAS 変異は、ダイレクトシークエンス法、MEBGEN™ RASKET KITともに29サンプル (15%) で検出され、一致率は98.4% (95% CI: 95.5-99.7%) であった (表2)。
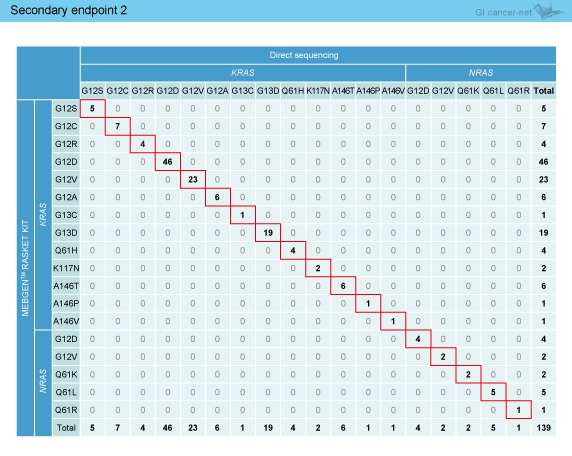
 また、ダイレクトシークエンス法とMEBGEN™ RASKET KITでKRAS /NRAS 変異が検出された全例における各変異の遺伝子型の一致率は100% (95% CI: 97-100%) であり、不一致は存在しなかった (表3)。
また、ダイレクトシークエンス法とMEBGEN™ RASKET KITでKRAS /NRAS 変異が検出された全例における各変異の遺伝子型の一致率は100% (95% CI: 97-100%) であり、不一致は存在しなかった (表3)。
 なお、MEBGEN™ RASKET KITにより、KRAS exon 2変異は37.1%に認められ、KRAS exon 2野生型の15%にminor RAS 変異が認められた (図2)。
なお、MEBGEN™ RASKET KITにより、KRAS exon 2変異は37.1%に認められ、KRAS exon 2野生型の15%にminor RAS 変異が認められた (図2)。
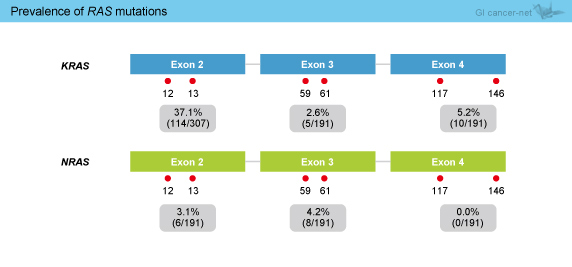
表1

表2

表3

図2

本解析により、新規のマルチプレックス検査キットMEBGEN™ RASKET KITの臨床的有効性が証明された。本キットは大腸癌のFFPEを用いてKRAS /NRAS exon 2, 3, 4の全変異を迅速かつ正確に検出することが可能である。
このサイトは医療関係者の方々を対象に作成しています。必ずご利用規約に同意の上、ご利用ください。記事内容で取り上げた薬剤の効能・効果および用法・用量には、日本国内で承認されている内容と異なるものが、多分に含まれていますのでご注意ください。

