The European Cancer Congress 2013 - ESMO

先日The New England Journal of MedicineにPRIME試験のRAS 遺伝子解析結果が報告されたように1)、現在臨床で行われているKRAS 遺伝子のcodon 12, 13にKRAS の他の部位の変異とNRAS 遺伝子の検査を加えて検討すると、FOLFOXに対してPanitumumabの上乗せがPFSで 7.9ヵ月 vs. 10.1ヵ月 (HR=0.72)、OSで20.2ヵ月 vs. 26.0ヵ月 (HR=0.78) と、切除不能進行・再発大腸癌患者においてPanitumumabの適切な治療対象を確定できることが報告された。そして、今回報告されたPRIME試験のupdateではOSに関する意義が明確になってきた。それと同時に、同様のRAS 遺伝子の解析報告であるBevacizumabとPanitumumabを比較したPEAK試験から、「RAS 野生型であれば抗EGFR抗体薬が1st-line」という使い分け対象が明確になってきた。
FIRE-3試験のRAS 解析の報告とも併せて検討すると、抗EGFR抗体薬はRAS 野生型の対象に用いるべきことが確立されたと言える。これらの薬剤の添付文書の改訂は少し先のこととなるであろうが、患者を適切に治療するためにも本邦での検査体制の整備が急務である。

PEAK試験はKRAS exon 2野生型の切除不能進行・再発大腸癌に対する1st-lineにおいてPanitumumab + mFOLFOX6 (Panitumumab群) とBevacizumab + mFOLFOX6 (Bevacizumab群) を比較検討した第II相臨床試験である。これまでにKRAS exon 2野生型に対する初回解析 (データカットオフ日: 2012年5月30日) の結果、ならびにRAS (KRAS /NRAS exon 2, 3, 4) 野生型における解析結果が報告されている。
今回は2013年1月3日をデータカットオフとして、RAS 変異に関する有効性および安全性の結果が報告された。
対象はECOG PS 0/1のKRAS exon 2野生型切除不能進行・再発大腸癌であり、抗VEGF療法および抗EGFR療法による治療経験のない症例とした。
RAS としては、KRAS exon 2 (codon 12, 13)、exon 3 (codon 59, 61)、exon 4 (codon 117, 146)、NRAS exon 2 (codon 12, 13)、exon 3 (codon 59, 61)、exon 4 (117, 146) を解析し、サンガー法によるDNAシークエンシングならびにWAVE-based SURVEYOR® Scan Kitを用いて遺伝子変異の有無を測定した。
主要評価項目はPFS、副次評価項目はOS、奏効率、切除率、安全性であり、RAS 野生型におけるPFS、OS、奏効率、安全性の評価も副次評価項目に含まれた。
KRAS exon 2野生型の250例中221例でRAS 解析による評価が可能であり、全てが野生型である症例 (RAS 野生型) は170例であり、いずれかに変異を有する症例 (KRAS exon 2野生型・RAS 変異型) は51例であった。
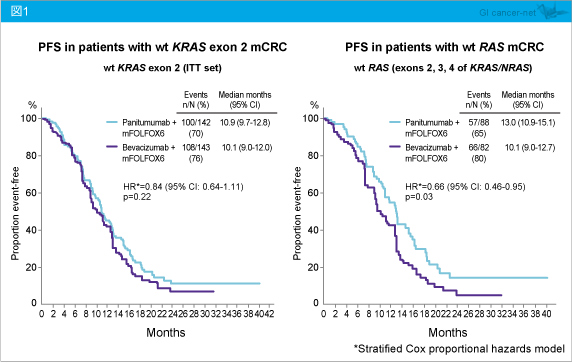
KRAS exon 2野生型におけるPFS中央値は、Panitumumab群10.9ヵ月、Bevacizumab群10.1ヵ月であり、有意差を認めなかった (HR=0.84, 95% CI: 0.64-1.11, p=0.22)。一方、RAS 野生型においては、それぞれ13.0ヵ月、10.1ヵ月であり、Panitumumab群で有意に延長した (HR=0.66, 95% CI: 0.46-0.95, p=0.03) (図1)。
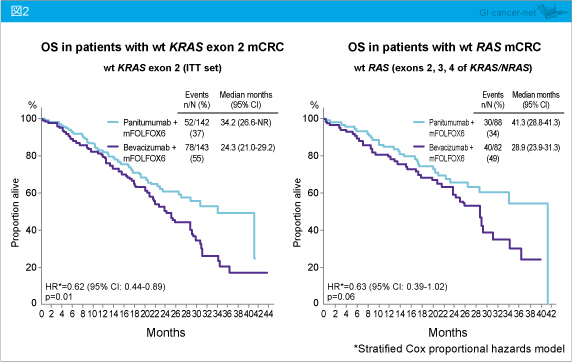
また、KRAS exon 2野生型におけるOS中央値は、Panitumumab群34.2ヵ月、Bevacizumab群24.3ヵ月であり、Panitumumab群で有意に延長した (HR=0.62, 95% CI: 0.44-0.89, p=0.01)。一方、RAS 野生型においては、それぞれ41.3ヵ月、28.9ヵ月であった (HR=0.63, 95% CI: 0.39-1.02, p=0.06) (図2)。
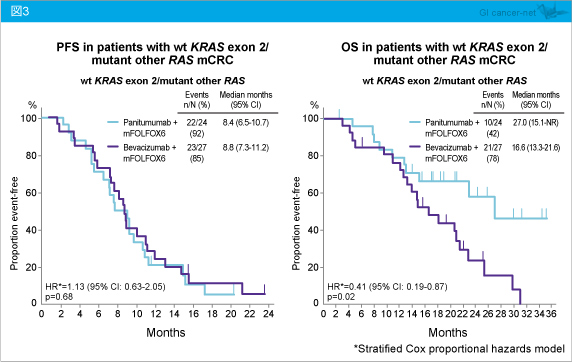
なお、KRAS exon 2野生型・RAS 変異型においては、PFSは両群で同程度であるが (HR=1.13, 95% CI: 0.63-2.05, p=0.68)、OSではPanitumumab群で有意に延長していた (HR=0.41, 95% CI: 0.19-0.87, p=0.02) (図3)。
RAS 野生型における後治療は、抗EGFR抗体薬がPanitumumab群22%、Bevacizumab群37%、VEGF阻害剤がそれぞれ40%、33%であり、KRAS exon 2野生型における解析と同等であったが、KRAS exon 2野生型・RAS 変異型においては、抗EGFR抗体薬がそれぞれ25%、44%、VEGF阻害剤がそれぞれ50%、7%、CPT-11・L-OHP・フッ化ピリミジン系製剤ベースの治療がそれぞれ83%、56%であった。
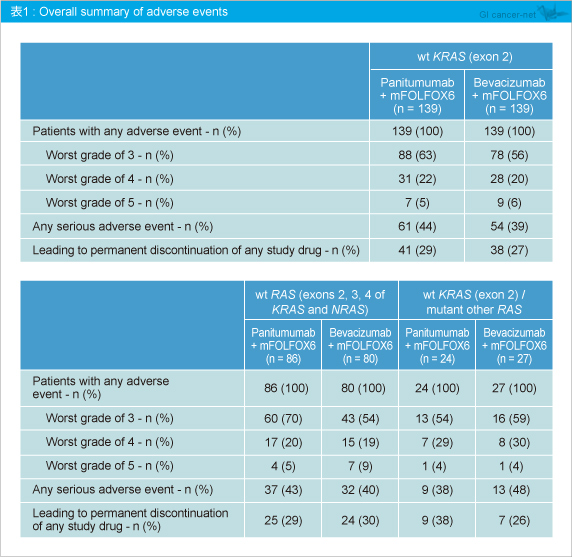
有害事象は既報と同程度であった (表1)。なお、RAS 変異の有無別における有害事象の発現には差を認めなかった。
今回のupdate解析の結果から、RAS 野生型の切除不能進行・再発大腸癌に対する1st-lineにおいて、Panitumumab + mFOLFOX6がBevacizumab + mFOLFOX6よりもPFS、OSともに有意に延長することが示された。なお、KRAS exon 2野生型・RAS 変異型においてOSに差が認められたのは、Panitumumab群では後治療が充実していたことが要因として挙げられる。
以上より、KRAS exon 2のみならずRAS 変異の有無を評価することは、Panitumumab治療をより効果的なものにすると考えられる。
(写真は共同演者のSalvatore Siena氏)

PRIME試験はKRAS exon 2野生型の切除不能進行・再発大腸癌を対象に、Panitumumab ± FOLFOX4の有効性と安全性を検討した第III相臨床試験である。
事前にKRAS exon 3 (codon 61)、exon 4 (117, 146)、NRAS exon 2 (codon 12, 13)、exon 3 (codon 61)、exon 4 (codon 117, 146)、BRAF exon 15 (codon 600) 変異の解析が設定されており、本年の米国臨床腫瘍学会で初回解析時点 (OSイベント発生率54%) におけるRAS 解析が発表された。同様に、データカットオフを2013年1月24日としたOSのupdate解析 (OSイベント発生率82%) も報告された。
そこで今回は、OSイベント発生率82%時点におけるRAS 変異の有無別の有効性および安全性に関する検討が行われた。
KRAS exon 2の評価には、Therascreen® KRAS Mutation Kitを用い、KRAS exon 3, 4, NRAS exon 2, 3, 4, BRAF exon 15については、標準であるサンガー法によるDNAシークエンシングならびにWAVE-based SURVEYOR® Scan Kitを用いて遺伝子変異の有無を測定した。
PRIME試験で無作為化された1,183例中1,060例 (90%) でRAS 変異の有無が明らかになった。このうち440例がKRAS exon 2変異型であったため、620例でRAS 変異が評価可能だった。またBRAF 変異の有無は619例 (52%) で明らかになった。
各遺伝子変異は、KRAS exon 2: 40.1%、exon 3: 4.5%、exon 4: 5.8%、NRAS exon 2: 3.5%、exon 3: 4.4%、exon 4: 0%、BRAF exon 15: 8.6%であった。
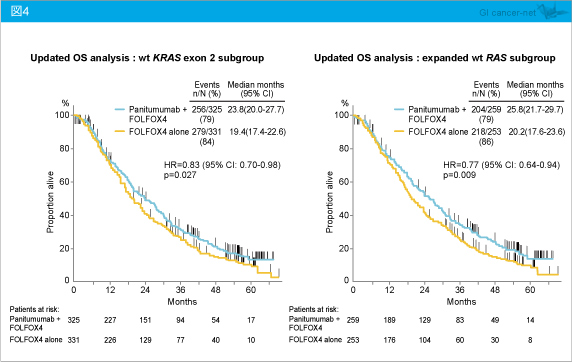
KRAS exon 2野生型におけるOS中央値は、Panitumumab + FOLFOX4群23.8ヵ月、FOLFOX4群19.4ヵ月であり、Panitumumab + FOLFOX4群で有意に延長した (HR=0.83, 95% CI: 0.70-0.98, p=0.027)。同様にRAS 野生型においても、OS中央値はそれぞれ25.8ヵ月、20.2ヵ月であり、Panitumumab + FOLFOX4群でOSを有意に延長し (HR=0.77, 95% CI: 0.64-0.94, p=0.009)、そのベネフィットはKRAS exon 2野生型よりも優れるものであった (図4)。
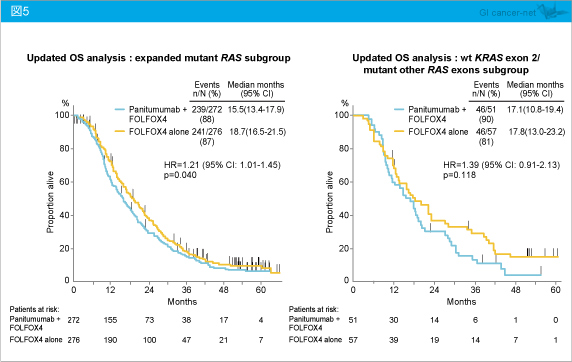
一方、KRAS exon 2を含むいずれかのRAS に変異を有する症例 (RAS 変異型) (HR=1.21, 95% CI: 1.01-1.45, p=0.040)、KRAS exon 2野生型でRAS 変異型 (HR=1.39, 95% CI: 0.91-2.13, p=0.118) においては、Panitumumab + FOLFOX4群はFOLFOX4群と比較し、OSが不良であった (図5)。
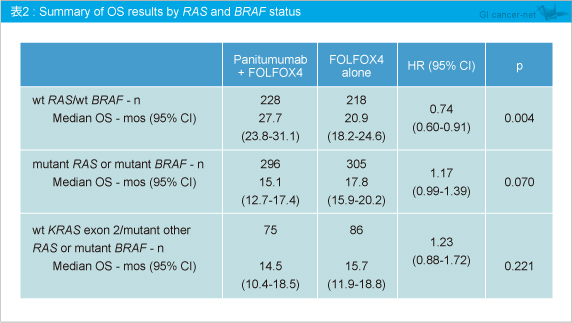
なお、RAS 解析にBRAF 変異の有無を追加すると、RAS /BRAF 野生型ではPanitumumab 併用によるOS延長効果が強い傾向があったものの、BRAF 変異を有する症例では、Panitumumab + FOLFOX4群、FOLFOX4群いずれもOSは不良な傾向にあった (表2)。
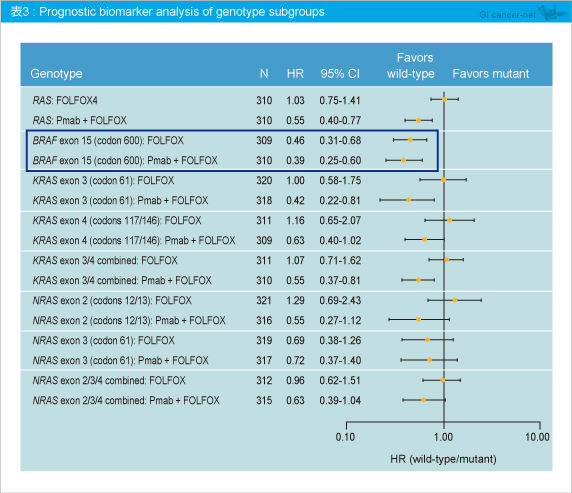
また、遺伝子変異別に予後因子の解析を行ったところ、BRAF 野生型においてPanitumumab + FOLFOX4群 (HR=0.39)、FOLFOX4群 (HR=0.46) ともに有意に良好であった (表3)。
有害事象は既報と同様であり、新たな有害事象はみられなかった。
今回のupdate解析の結果から、RAS 野生型ではPanitumumab + FOLFOX4群はFOLFOX4群と比較し、OS中央値で5.6ヵ月有意に延長することが示された。一方、RAS 変異型ではPanitumumab + FOLFOX4群でOSが短縮傾向にあった。 一方、BRAF V600E変異はPanitumumab + FOLFOX4の効果予測因子ではなく、両群の予後因子として作用していることが示された。