2011年9月23日〜27日にスウェーデン・ストックホルムにて開催されたThe European Multidisciplinary Cancer Congress 2011 - ESMOより、大腸癌や胃癌などの注目演題のレポートをお届けします。演題レポートの冒頭には、臨床研究の第一線で活躍する監修ドクターのコメントを掲載しています。

転移を有する膵癌患者に対するGemcitabine + Erlotinib±Bevacizumab療法を検討した無作為化比較第III相試験 (AVITA試験): 血液生化学的バイオマーカーの解析
Analysis of Blood Plasma Factors in the Phase III AVITA Randomise,
Placebo-controlled Study of Gemcitabine + Erlotinib with or without
Bevacizumab in Patients with Metastatic Pancreatic Cancer.
Eric Van Cutsem, et al.

Bevacizumabに初の効果予測バイオマーカーの誕生なるか?
今後の検証的臨床試験に期待
今後の検証的臨床試験に期待

また、本学会では#804の報告において、AVF2107g試験 (大腸癌: 394例)、AVAiL試験 (非小細胞肺癌: 567例)、AVOREN試験 (腎細胞癌: 400例)、AVADO試験 (乳癌: 265例)、AVAGAST試験 (胃癌: 712例) と本試験を対象とし、pVEGF-Aにのみに焦点を絞って検討した結果が報告された1)。結果は膵癌、胃癌、乳癌においては、pVEGF-A高値例においてOS、progression-free survival (PFS) が不良であったとのことであった。また、これら3試験においては、pVEGF-Aが高値になるほどBV併用群の予後 (OS、PFS) がplacebo群に比較して良好であったことから、効果予測因子となる可能性が示唆された。BVが標準治療のひとつとして世に出てから数年が経つが、その効果予測としてのバイオマーカーは未だに確立されておらず、本報告の如く、患者採血によりその効果予測が可能となれば、がん治療計画において多大なる意味をなすものと思われる。VEGFがBVのバイオマーカーになる可能性に関しては、以前から言われており、今後はそれを主目的とした臨床試験において証明されることが肝心である。会場では演者が「現時点では、実臨床においてVEGFをバイオマーカーとして採用して治療方針を立てるべきではなく、あくまでも検証的臨床試験の結果を待ってから実施すべきだ」と述べており、やはり私もその意見に賛成である。
転移を有する膵癌患者に対するBevacizumab併用の有用性を検討した第III相試験 (AVITA試験)* では、主要評価項目であるOSは達成されなかったが、副次的評価項目のPFSの延長は認められている2)。また、最近報告された転移・再発乳癌のデータでは、血漿中のVEGF-A (pVEGF-A) およびVEGFR2 (pVEGFR2) 高値がBevacizumab投与患者におけるPFS延長の予測因子であることが示唆されている3)。
今回、AVITA試験の登録症例を対象に、血液生化学的バイオマーカーとBevacizumabの有効性の関連をretrospectiveに検討した。
*AVITA試験: 転移を有する膵癌患者607例に対する1st-line治療としてのGemcitabine + Erlotinib (GE) ±Bevacizumab (5mg/kg, q2w) のプラセボ対照無作為化比較第III相試験
今回、AVITA試験の登録症例を対象に、血液生化学的バイオマーカーとBevacizumabの有効性の関連をretrospectiveに検討した。
*AVITA試験: 転移を有する膵癌患者607例に対する1st-line治療としてのGemcitabine + Erlotinib (GE) ±Bevacizumab (5mg/kg, q2w) のプラセボ対照無作為化比較第III相試験
ベースライン時の血漿サンプルを用い、VEGF-A、VEGFR1、VEGFR2、E-selectinを新規ELISA法によって測定した。VEGF-D、bFGF、HGF等のその他のバイオマーカーについても追加解析した。
ベースライン時の各バイオマーカーの中央値をカットオフ値として低値 (low) または高値 (high) に分類し、PFSならびにOSとの関連を調べた。
ベースライン時の各バイオマーカーの中央値をカットオフ値として低値 (low) または高値 (high) に分類し、PFSならびにOSとの関連を調べた。
AVITA試験の登録患者607例中221例 (36%) でベースライン時の血漿サンプルが利用可能であった。Bevacizumab併用群とplacebo群の患者背景に偏りはみられなかった。
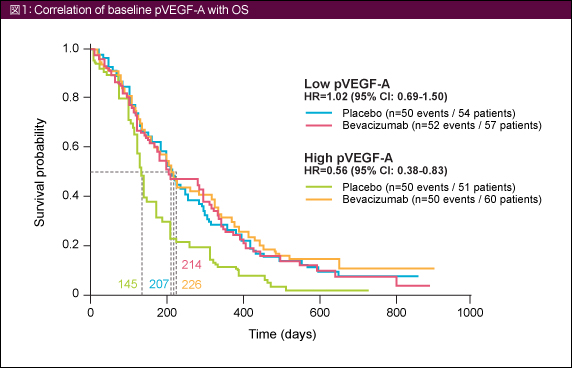
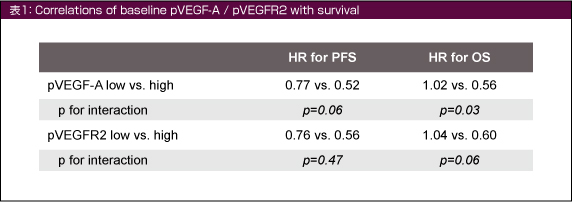
OSのHRはベースライン時のpVEGF-A低値例で1.02 (95% CI: 0.69-1.50)、高値例で0.56 (同: 0.38-0.83) であり、交互作用が認められた (p for interaction=0.03) (図1)。PFSにおいても同様であり (同低値例: HR=0.77 [95% CI=0.53-1.13], 同高値例: HR=0.52 [95% CI=0.35-0.78], p for interaction=0.06)、ベースライン時のpVEGF-A高値とOSおよびPFS延長の関連が認められた。
OSのHRはベースライン時のpVEGF-A低値例で1.02 (95% CI: 0.69-1.50)、高値例で0.56 (同: 0.38-0.83) であり、交互作用が認められた (p for interaction=0.03) (図1)。PFSにおいても同様であり (同低値例: HR=0.77 [95% CI=0.53-1.13], 同高値例: HR=0.52 [95% CI=0.35-0.78], p for interaction=0.06)、ベースライン時のpVEGF-A高値とOSおよびPFS延長の関連が認められた。
また、ベースライン時のpVEGFR2高値例と低値例の間にも交互作用が認められ、pVEGFR2高値例ではplacebo群に比してBevacizumab併用群のOSが良好であったが、PFSとの関連はみられなかった (表1)。
転移を有する膵癌患者に対するretrospectiveな解析より、pVEGF-AとpVEGFR2はBevacizumabの有望な効果予測因子である可能性が示唆された。また、pVEGF-AとpVEGFR2の関連はみられず、それぞれが独立した予測因子であると考えられた。その他のバイオマーカーについてはOS、PFSとの関連は示されなかった。これらの解析結果は転移・再発乳癌の既報3) と同様であった。
Bevacizumabの効果予測因子としてのpVEGF-Aについては、複数の癌腫における解析結果を本会にて報告予定である (Jayson GC, et al.: abst #804) 1)。
Bevacizumabの効果予測因子としてのpVEGF-Aについては、複数の癌腫における解析結果を本会にて報告予定である (Jayson GC, et al.: abst #804) 1)。
Reference
1) Jayson GC, et al.: The European Multidisciplinary Cancer Congress 2011 (16th ECCO-36th ESMO): abst #804
2) Van Cutsem E, et al.: J Clin Oncol. 27(13): 2231-2237, 2009 [PubMed]
3) Miles DW, et al.: SABCS 2010: P2-16-04 [SABCS abstracts]
1) Jayson GC, et al.: The European Multidisciplinary Cancer Congress 2011 (16th ECCO-36th ESMO): abst #804
2) Van Cutsem E, et al.: J Clin Oncol. 27(13): 2231-2237, 2009 [PubMed]
3) Miles DW, et al.: SABCS 2010: P2-16-04 [SABCS abstracts]
このサイトは医療関係者の方々を対象に作成しています。必ずご利用規約に同意の上、ご利用ください。記事内容で取り上げた薬剤の効能・効果および用法・用量には、日本国内で承認されている内容と異なるものが、多分に含まれていますのでご注意ください。

