2011年9月23日〜27日にスウェーデン・ストックホルムにて開催されたThe European Multidisciplinary Cancer Congress 2011 - ESMOより、大腸癌や胃癌などの注目演題のレポートをお届けします。演題レポートの冒頭には、臨床研究の第一線で活躍する監修ドクターのコメントを掲載しています。

切除不能進行・再発大腸癌に対する抗EGFR抗体薬の効果予測因子としてのKRAS codon 12,13変異
2010年にJAMAに掲載された切除不能進行・再発大腸癌既治療例に対するCetuximabの臨床試験のプール解析1)
は、KRAS 変異型では抗EGFR抗体薬の効果は得られないという近年の大腸癌治療のコンセンサスに一石を投じるものであった。今回、Panitumumabの3つの第III相試験におけるKRAS codon 12、13変異の解析 (#33LBA) と、東京・九州のグループによるKRAS G13D変異の検討結果 (#6014) が報告された。
効果予測因子のグレイゾーンに対する実臨床での対応

KRAS (codon 12, 13) 変異例に対し抗EGFR抗体薬の効果が得られ難いという現在の通説は、いくつかの後ろ向き研究結果から得られたものである。前向きに検証した試験結果から得られた治療効果の予測因子ではない。そのKRAS 変異例を詳細に見直した結果、codon 13変異では明らかに抗EGFR抗体薬が無効とはいえないという結果が得られた。NCIC CTG CO.17試験 (抗癌剤不応例に対するCetuximab単剤とbest supportive care (BSC) 単独の無作為化第III相試験)3) は変異型も含めた全大腸癌患者を対象にCetuximabの有意な延命効果を示した試験であり、明確な無効予測因子とはいえないcodon 13変異例にCetuximabを投与しない理由はない。これらの理由から、当院では抗癌剤不応のcodon 13変異例に抗EGFR抗体薬の投与を行っている。KRAS codon 13変異例は、大腸癌全体の約10%と少ないため、容易には臨床試験を行うことはできない。レトロスペクティブな結果からは、抗癌剤不応のcodon 13変異例でCetuximab + Irinotecan (CPT-11) の併用療法が有効である可能性がみられているが、野生型に比べると延命効果が少ないことは予想され、わずかな差を検証するために多くの症例数を要する試験となるであろう。一方で、頻度が低いこと、および検査が保険適応とならないことから、BRAF 、NRAS 、KRAS codon 61, 146の変異のある抗癌剤不応例に対しては、KRAS codon 12変異例同様に抗EGFR抗体薬の効果を得られ難いことは既知であるものの、抗EGFR抗体薬を投与しているのが実情であり、これらの変異を調べる検査を広く一般に行えるようにすることはG13Dとは別に重要な課題である。
ガイドラインや添付文書の記載を簡単に変更することはできないため、一度、無効予測因子として扱ったcodon 13変異例に対する有効性を証明する臨床試験が必要という意見も出るであろうが、BRAF 変異など他の無効予測因子も含めて、治療の個別化を考えるようにしたい。
JAMAの結果から、抗癌剤不応のKRAS codon 13変異例に対するCetuximabの治療効果は単剤では少なく、CPT-11との併用でより明確にみられている。今回のPanitumumabの臨床試験での解析 (#33LBA) では、抗癌剤不応例を対象とした20020408試験でPanitumumab単剤の投与が行われており、Cetuximabでみられた差が得られ難かった可能性はある。また、この少ないサブセットに対する治療効果を検出できる統計デザインではないため、先行研究でみられた成果を再現することができなくても止むを得ない。OSのハザード比は初回治療のPRIME試験で0.83、二次治療の20050181試験で0.85、抗癌剤不応例を対象とした20020408試験で0.99といずれもハザード比が1に近い臨床試験であり、症例数の少ないcodon 13変異例に対するPanitumumabの上乗せ効果を検出できなくても仕方がない。言い換えれば、JAMAの検討で、最も治療効果に差がみられた、抗癌剤不応例に対するPanitumumab + CPT-11併用療法とBSC単独との比較試験があればJAMA同様の結果が再現できたかもしれない。Osakoらの発表 (#6014) は、PFS、OSの値からすると、抗癌剤不応例に対象は絞り込まれていないかもしれないが、両群で前治療歴に大きな偏りがなければ、G13Dに対するCetuximabの有効性を示唆するような研究発表である。
Abstract #33LBA
切除不能進行・再発大腸癌における予後ならびにPanitumumabの効果予測因子としてのKRAS codon 12および13変異の評価
Evaluation of Individual Codon 12 and 13 Mutant (MT) KRAS Alleles as Prognostic and Predictive Biomarkers of Response to Panitumumab (pmab) in Patients with Metastatic Colorectal Cancer (mCRC)
Marc Peeters, et al.

切除不能進行・再発大腸癌患者を対象とした3つの第III相試験 (20050203/PRIME試験、20050181試験、20020408試験) の結果より、1st-line、2nd-lineおよび3rd-line治療におけるPanitumumabの化学療法併用または単剤としての有用性が認められている4-6)。また、KRAS codon 12および13の変異は、切除不能進行・再発大腸癌における抗EGFR抗体薬のnegativeな効果予測バイオマーカーとして確立されている。
今回、前出の3つの第III相試験におけるKRAS codon 12、13の変異の予後因子および効果予測因子としてのインパクトを評価した。
今回、前出の3つの第III相試験におけるKRAS codon 12、13の変異の予後因子および効果予測因子としてのインパクトを評価した。
3つの第III相試験に登録された切除不能進行・再発大腸癌患者を対象とした (表1)。
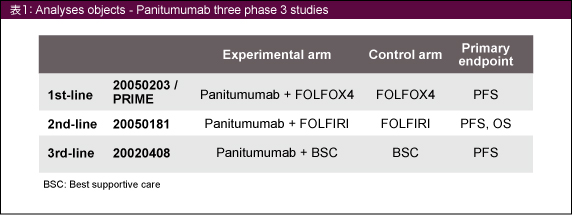
KRAS 遺伝子検査は、KRAS codon 12および13で最も一般的な7種類の変異 (G12A, G12C, G12D, G12R, G12S, G12V, G13D) を検出するTherascreen® K-RAS Mutation Kit (Qiagen社) を用いて行った。
KRAS statusが確認できたのはPRIME試験で93%、20050181試験で91%、20020408試験では92%であった。KRAS codon 12および13における変異の検出率はそれぞれ40% (441/1,096例)、45% (486/1,083例)、43% (184/427例) であった。各試験におけるKRAS 遺伝子変異の分布は一定で治療群間の偏りはなく、既報の切除不能進行・再発大腸癌における変異の比率と一致するものであった。また、ベースラインの患者背景は、KRAS 変異のサブグループ間で差はみられなかった。
Prognostic Effect
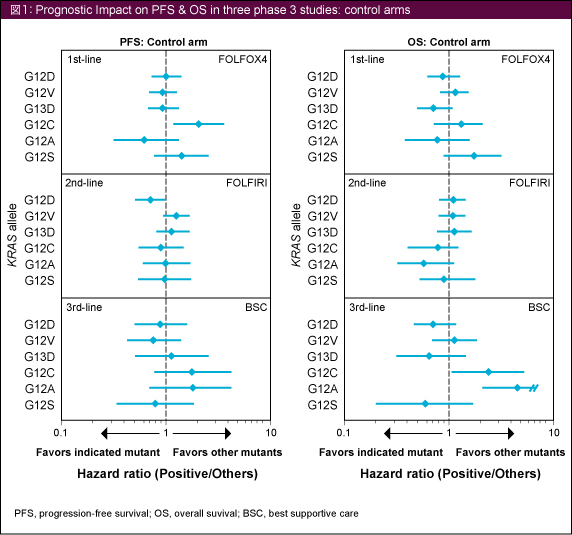
3試験の対照群 (FOLFOX4, FOLFIRI, BSC) における個々のKRAS 変異は、PFSまたはOSの結果に一貫した関連を示さなかった (図1)。
Prognostic Effect
3試験の対照群 (FOLFOX4, FOLFIRI, BSC) における個々のKRAS 変異は、PFSまたはOSの結果に一貫した関連を示さなかった (図1)。
Predictive Effect
Panitumumab群における個々のKRAS 変異は、PFSまたはOSの結果に一貫した関連を示さなかったが、PRIME試験では次の2種類のKRAS 変異において有意な差が認められた (図2)。KRAS G12V変異においては、Panitumumab + FOLFOX4群のOSがFOLFOX4群に比べて有意に優れていたが (p=0.0369)、G13D変異においてはFOLFOX4群のほうが有意に優れていた (p=0.0018)。
Panitumumab群における個々のKRAS 変異は、PFSまたはOSの結果に一貫した関連を示さなかったが、PRIME試験では次の2種類のKRAS 変異において有意な差が認められた (図2)。KRAS G12V変異においては、Panitumumab + FOLFOX4群のOSがFOLFOX4群に比べて有意に優れていたが (p=0.0369)、G13D変異においてはFOLFOX4群のほうが有意に優れていた (p=0.0018)。
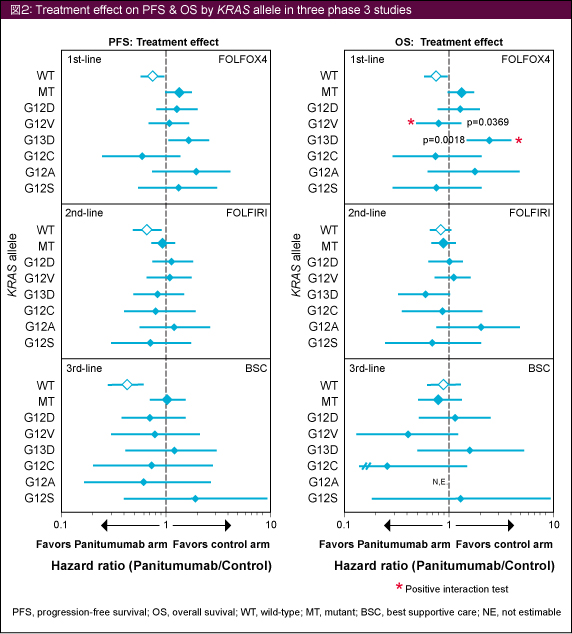
プール解析の結果では、KRAS G12A変異においてPanitumumab群のOSが有意に劣っており、G12A変異はOSにおけるPanitumumabの治療効果を予測する唯一のnegativeな因子であった。
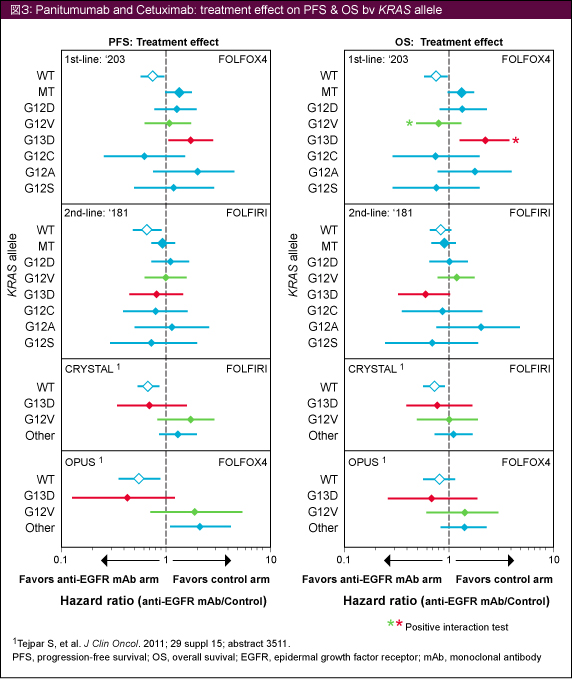
1st-line治療におけるCetuximabの臨床試験のプール解析結果5)と比較すると、OPUS試験 (FOLFOX4±Cetuximab療法) では、KRAS G13D変異においてCetuximab併用によるOSの延長が認められたのに対し、本解析のPRIME試験ではFOLFOX4療法のほうが有意に良好であり、相反する結果であった (図3)。
1st-line治療におけるCetuximabの臨床試験のプール解析結果5)と比較すると、OPUS試験 (FOLFOX4±Cetuximab療法) では、KRAS G13D変異においてCetuximab併用によるOSの延長が認められたのに対し、本解析のPRIME試験ではFOLFOX4療法のほうが有意に良好であり、相反する結果であった (図3)。
本解析結果より、KRAS codon 12または13の変異を有する切除不能進行・再発大腸癌患者においては、Panitumumabによるベネフィットが得られないと考えられた。現段階では、Panitumumabの治療対象はKRAS 野生型の患者に限定すべきである。
Abstract #6014
KRAS 遺伝子p.G13D変異を有する切除不能進行・再発大腸癌は日本人患者においてprogression-free survivalを延長する可能性がある
Cetuximab Treatment for Metastatic Colorectal Cancer With KRAS p.G13D Mutation May Improve Progression-free Survival in Japanese Patients
Masahiko Osako, et al.

最近の後ろ向き研究において、KRAS G13D変異を有する患者におけるCetuximabの治療効果が他の変異症例と比較して優れていることが報告されている1)。
本研究の目的は、日本人の切除不能進行・再発大腸癌患者におけるKRAS G13D変異の頻度と、G13D変異症例とその他の変異症例におけるCetuximabの治療効果を後ろ向きに評価することである。
東京および九州の4施設において、組織学的に切除不能進行・再発大腸癌と確認されたKRAS 変異型患者98例を対象に、患者背景およびKRAS G13D変異の頻度を検討した。
KRAS 遺伝子変異の頻度はG13D変異が23例 (23.5%)、その他の変異が75例 (76.5%)であり、過去の報告とほぼ同等であった1,7-8)。年齢や組織型に差はみられなかったが、女性がそれぞれ65.2%、40.0% (p=0.05)、結腸原発は73.9%、52.0% (p=0.08) であり、日本人を対象とした報告8) と同様の傾向がみられた。Cetuximab治療を受けた症例 (9例、22例) の患者背景にも偏りはみられなかった。
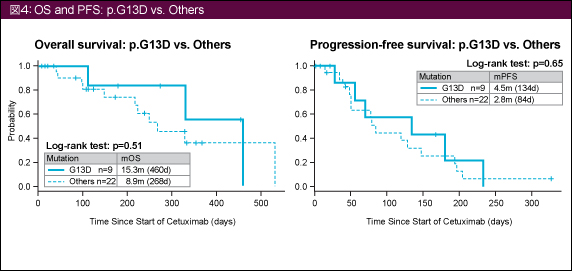
OSおよびPFSの中央値は図4に示す通りである。KRAS G13D変異とその他の変異で有意差は認められていないが、いずれもKRAS G13D変異症例で延長傾向にあった。
OSおよびPFSの中央値は図4に示す通りである。KRAS G13D変異とその他の変異で有意差は認められていないが、いずれもKRAS G13D変異症例で延長傾向にあった。
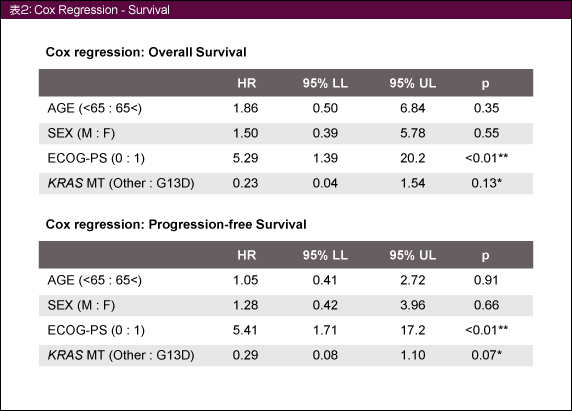
多変量解析の結果では、OS、PFSともにECOG PS (0 vs. 1)で有意な差がみられたが (ともにp<0.01)、KRAS G13D変異とその他の変異では傾向がみられるに留まった (表2)。
KRAS G13D変異を有する患者では、他のKRAS 変異を有する患者に比べてCetuximabの効果を得られると考えられた。臨床試験により、KRAS G13D変異を有する切除不能進行・再発大腸癌患者におけるCetuximab治療のベネフィットを明らかにする必要がある。
Reference
1) De Roock W, et al.: JAMA. 304 (16): 1812-1820, 2010 [Pubmed] [論文紹介]
2) Guerrero S, et al.: Cancer Res. 60(23): 6750-6756, 2000 [PubMed]
3) Karapetis CS, et al: N Engl J Med. 359(17): 1757-1765, 2008 [PubMed][論文紹介]
4) Douillard JY, et al.: 2011 Annual Meeting of the American Society of Clinical Oncology®: abst #3510 [学会レポート]
5) Peeters M, et al.: J Clin Oncol. 28(31): 4706-4713, 2010 [Pubmed]
6) Amado RG, et al.: J Clin Oncol. 26(10): 1626-1634, 2008 [Pubmed]
7) Tejpar S, et al.: 2011 Annual Meeting of the American Society of Clinical Oncology®: abst #3511 [学会レポート]
8) Uetake H, et al.: 2011 Annual Meeting of the American Society of Clinical Oncology®: abst #3605
1) De Roock W, et al.: JAMA. 304 (16): 1812-1820, 2010 [Pubmed] [論文紹介]
2) Guerrero S, et al.: Cancer Res. 60(23): 6750-6756, 2000 [PubMed]
3) Karapetis CS, et al: N Engl J Med. 359(17): 1757-1765, 2008 [PubMed][論文紹介]
4) Douillard JY, et al.: 2011 Annual Meeting of the American Society of Clinical Oncology®: abst #3510 [学会レポート]
5) Peeters M, et al.: J Clin Oncol. 28(31): 4706-4713, 2010 [Pubmed]
6) Amado RG, et al.: J Clin Oncol. 26(10): 1626-1634, 2008 [Pubmed]
7) Tejpar S, et al.: 2011 Annual Meeting of the American Society of Clinical Oncology®: abst #3511 [学会レポート]
8) Uetake H, et al.: 2011 Annual Meeting of the American Society of Clinical Oncology®: abst #3605
このサイトは医療関係者の方々を対象に作成しています。必ずご利用規約に同意の上、ご利用ください。記事内容で取り上げた薬剤の効能・効果および用法・用量には、日本国内で承認されている内容と異なるものが、多分に含まれていますのでご注意ください。

