2011年9月23日〜27日にスウェーデン・ストックホルムにて開催されたThe European Multidisciplinary Cancer Congress 2011 - ESMOより、大腸癌や胃癌などの注目演題のレポートをお届けします。演題レポートの冒頭には、臨床研究の第一線で活躍する監修ドクターのコメントを掲載しています。

切除不能進行・再発大腸癌患者に対する1st-line治療としてのmFOLFOX6 + Sorafenib療法の有用性を検討したプラセボ対照二重盲検無作為化比較第IIb相試験: RESPECT試験
A Phase 2b, Double-Blind, Randomized Study Evaluating the Efficacy and Safety of Sorafenib (SOR) Compared With Placebo (PBO) When Administered in Combination With Chemotherapy (Modified FOLFOX6) for First-line Treatment (tx) of Patients (Pts) With Metastatic Colorectal Cancer (mCRC). The RESPECT Trial.
Josep Tabernero, et al.

大腸癌1st-line化学療法におけるmulti-target TKIの限界

RESPECT試験はmFOLFOX6に対してSorafenibの生存における上乗せ効果を検証する試験である。主要評価項目 であるprogression-free survival (PFS) は達成されず、期待されたKRAS 変異型症例における探索的な解析でも有意な優越性は示されなかった。また、objective response rate (ORR) はSorafenib群が劣るという残念な結果であった。
現在までに、本試験も含め大腸癌1st-lineを対象として、VEGFRを主な標的とするmulti-target TKIのFOLFOXやFOLFIRI等への上乗せ効果を検証する数多くの試験が行われたが、全ての試験がネガティブな結果となっている。主な理由としてはmulti-target TKIが多彩で比較的強い毒性を呈することにより、ベースの化学療法のdose intensityが落ちるためと考えられている。
1st-lineにおいてmulti-target TKIが、毒性のマイルドなBevacizumabや抗腫瘍効果に優れるPanitumumab、Cetuximab (KRAS 野生型) に比較試験で勝つには、KRAS 変異も含めたバイオマーカーで効果の期待できる症例を絞り込むなどでより有意な有効性を発揮しなければ難しいものと思われる。単剤のサルベージラインでの開発はひとつの選択肢となると考えられる。現在、Sorafenibと同様の作用機序をもつ新規TKIであるRegorafenibのplaceboを対照とした比較試験 (CORRECT試験) が行われており、その結果が待たれるところである。
Sorafenibは血管新生と腫瘍増殖を阻害する経口のmulti-targetチロシンキナーゼ阻害薬であり、腎細胞癌および肝細胞癌の治療に用いられている。RESPECT試験は、Sorafenibを切除不能進行・再発大腸癌に対する1st-line治療としての有効性と安全性を検証した無作為化比較第II相試験である。
未治療の切除不能進行・再発大腸癌患者をmFOLFOX6 + Sorafenib群とmFOLFOX6 + placebo群に無作為に割り付けた。Sorafenib (400mg) とplaceboは1日2回、mFOLFOX6は2週毎の投与とした (図1)。
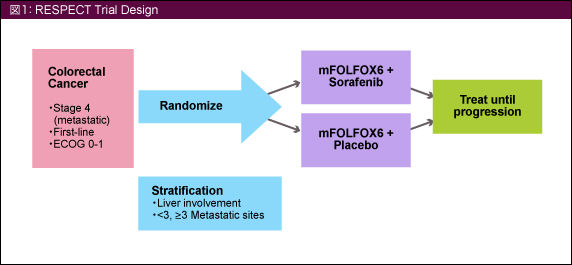
主要評価項目はPFSとし、副次的評価項目はoverall survival (OS)、time to progression (TTP)、ORR、安全性、QOL、バイオマーカー (KRAS およびBRAF ) による評価とした。
2011年1月の時点で198例が登録され、Sorafenib群は97例、placebo群は101例であった。
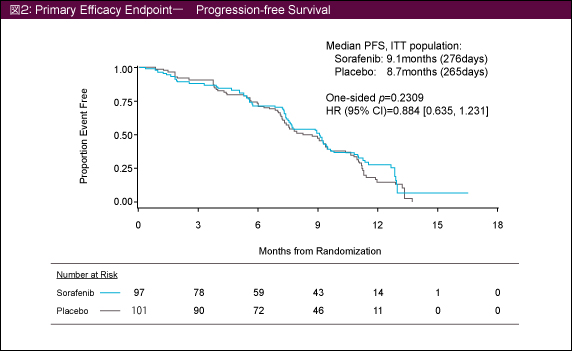
主要評価項目であるPFSの中央値は、Sorafenib群で9.1ヵ月、placebo群では8.7ヵ月であり、有意差は認められなかった (HR=0.884, 95% CI: 0.635-1.231, p=0.2309) (図2)。
主要評価項目であるPFSの中央値は、Sorafenib群で9.1ヵ月、placebo群では8.7ヵ月であり、有意差は認められなかった (HR=0.884, 95% CI: 0.635-1.231, p=0.2309) (図2)。
KRAS 遺伝子型別 (野生型83例、変異型76例) の探索的解析においても、両群間のPFSに有意な差は認められなかったが、KRAS 変異型においてはSorafenib群で良好な傾向にあった (8.9ヵ月 vs. 7.6ヵ月, HR=0.895, p=0.34)。
ORRはSorafenib群で46.4%、placebo群では60.4%であり、disease control rateはそれぞれ86.6%、91.1%であった。
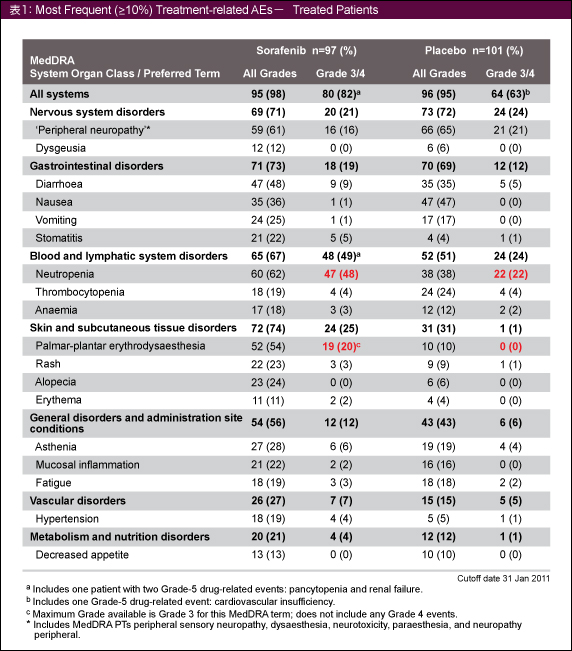
Grade3以上の有害事象はSorafenib群で82%、placebo群では63%、治療に関連した重篤な有害事象 (serious adverse events) はそれぞれ22%、16%であり、いずれもSorafenib群のほうが多かった。Sorafenib群で多くみられた有害事象は、好中球数減少、口内炎、下痢、皮膚および皮下組織障害、脱力感、高血圧などであった (表1)。
ORRはSorafenib群で46.4%、placebo群では60.4%であり、disease control rateはそれぞれ86.6%、91.1%であった。
Grade3以上の有害事象はSorafenib群で82%、placebo群では63%、治療に関連した重篤な有害事象 (serious adverse events) はそれぞれ22%、16%であり、いずれもSorafenib群のほうが多かった。Sorafenib群で多くみられた有害事象は、好中球数減少、口内炎、下痢、皮膚および皮下組織障害、脱力感、高血圧などであった (表1)。
治療中止事由は、病勢進行 (PD) がSorafenib群で51%、placebo群では64%とplacebo群で多く、有害事象によるものはSorafenib群で9%、placebo群で6%、患者希望・その他はそれぞれ22%、12%とSorafenib群で多かった。
また、Sorafenibとplaceboの投与期間はplacebo群で長く、総投与量および平均1日投与量もplacebo群のほうが多かった。Oxaliplatin / 5-FUの投与期間ならびに総投与量も同様であった。
また、Sorafenibとplaceboの投与期間はplacebo群で長く、総投与量および平均1日投与量もplacebo群のほうが多かった。Oxaliplatin / 5-FUの投与期間ならびに総投与量も同様であった。
切除不能進行・再発大腸癌患者の1st-line治療において、mFOLFOX6へのSorafenibの上乗せによるPFSの有意な延長は認められなかった。一方、サンプルサイズが小さいものの、KRAS 変異型患者においてはSorafenibの上乗せ効果が得られる可能性が示唆された。なお、有害事象の発現頻度はSorafenib群で一貫して高かった。
このサイトは医療関係者の方々を対象に作成しています。必ずご利用規約に同意の上、ご利用ください。記事内容で取り上げた薬剤の効能・効果および用法・用量には、日本国内で承認されている内容と異なるものが、多分に含まれていますのでご注意ください。

