2011年9月23日〜27日にスウェーデン・ストックホルムにて開催されたThe European Multidisciplinary Cancer Congress 2011 - ESMOより、大腸癌や胃癌などの注目演題のレポートをお届けします。演題レポートの冒頭には、臨床研究の第一線で活躍する監修ドクターのコメントを掲載しています。

切除不能進行・再発大腸癌患者に対する1st-line治療としてのmFOLFOX6 + BIBF1120療法 vs. mFOLFOX6 + Bevacizumab療法のオープンラベル無作為化比較第I / II相試験
A Phase I/II, Open-label, Randomised Study of BIBF 1120 Plus mFOLFOX6 Compared to Bevacizumab Plus mFOLFOX6 in Patients with Metastatic Colorectal Cancer
Eric Van Cutsem, et al.

BIBF 1120もBevacizumabのハードルは超えられず?

本試験は、統計学的に十分な差を検証できるような検証的第III相試験ではないため、決定的な判断はできないが、この結果報告をみる限りでは、残念ながらBIBF 1120はBVを超える効果をもった薬剤とはいえない。今後開発を続けるならば、副作用が少ないことを特徴とした薬剤としての開発をすることになるが、それに関してはディスカッサントもスライドのなかで疑問符をつけていた。ここのところさまざまなTKIの報告がなされるが、いずれもnegativeな結果に終わっていることからも、この系列の薬剤のなかからBVを超える有力な分子標的治療薬が登場し、開発されることはなかなか難しいものと思われた。
BIBF 1120はVEGFR1-3、PDGFR-α/β、FGFR1-3を阻害し血管新生を抑制するマルチキナーゼ阻害剤である。第I相試験において単剤としての安全性が証明されており、肝臓で代謝され、化学療法剤との相互作用は認められない。
切除不能進行・再発大腸癌患者に対する1st-line治療として、mFOLFOX6 + BIBF 1120療法とmFOLFOX6 + Bevacizumab療法を比較・検討した。
切除不能進行・再発大腸癌患者を対象とし、ECOG PS、LDHレベル、術後補助化学療法の有無で層別し、mFOLFOX6 + BIBF 1120群 (以下BIBF 1120群) とmFOLFOX6 + Bevacizumab群 (以下Bevacizumab群) に2:1の割合で無作為割付した (図1)。治療はPDあるいは忍容不能となるまで継続した。本試験は探索的優越性試験であり、正式な有意性や検出力はない。
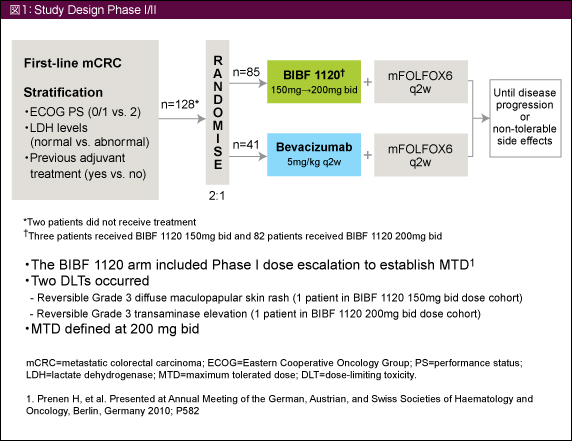
主要評価項目は治療開始9ヵ月時点のprogression-free survival rate (無増悪生存率)、副次的評価項目はoverall survival (OS)、PFS、objective response rate (ORR)、安全性、QOLとした。
126例がBIBF 1120群 (85例) とBevacizumab群 (41例) に無作為に割り付けられた。患者背景は両群間でほぼ同様であったが、肝限局転移症例はBIBF 1120群で28例 (32.9%)、Bevacizumab群で19例 (46.3%) であり、Bevacizumab群で多かった。
中間解析のデータベースのロックは最終登録患者の治療開始9ヵ月後に行われたが、47例 (37% [BIBF 1120群35%、Bevacizumab群41%]) が投与継続中であった。
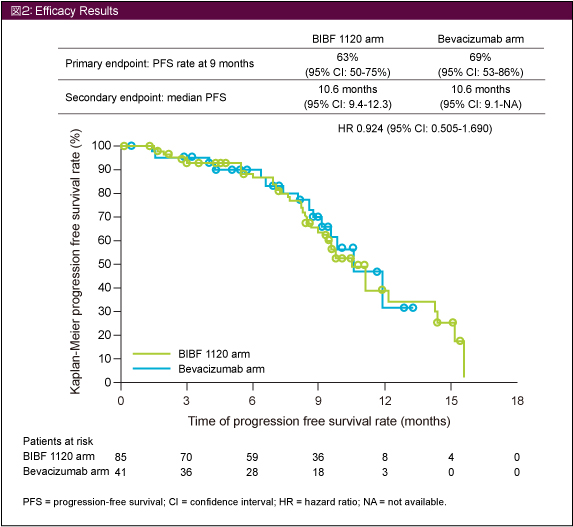
主要評価項目である治療開始9ヵ月時点の無増悪生存率はBIBF 1120群で63%、Bevacizumab群では69%、PFSの中央値は両群ともに10.6ヵ月 (HR=0.924, 95% CI: 0.505-1.690) であり、差は認められなかった (図2)。
中間解析のデータベースのロックは最終登録患者の治療開始9ヵ月後に行われたが、47例 (37% [BIBF 1120群35%、Bevacizumab群41%]) が投与継続中であった。
主要評価項目である治療開始9ヵ月時点の無増悪生存率はBIBF 1120群で63%、Bevacizumab群では69%、PFSの中央値は両群ともに10.6ヵ月 (HR=0.924, 95% CI: 0.505-1.690) であり、差は認められなかった (図2)。
ORRはBIBF 1120群61.2%、Bevacizumab群53.7%、奏効期間の中央値はそれぞれ8.0ヵ月、10.5ヵ月であった。また、切除率はそれぞれ14.1%、19.5%、R0切除率は5.9%、14.6%であった。
5-FUを減量せずに12サイクル以上完遂した患者の割合と投与期間は、両群で差はみられなかった。一方、Oxaliplatinを減量せずに12サイクル以上完遂した患者の割合はBIBF 1120群で31.8%、Bevacizumab群では17.1%と、Bevacizumab群で低かった。
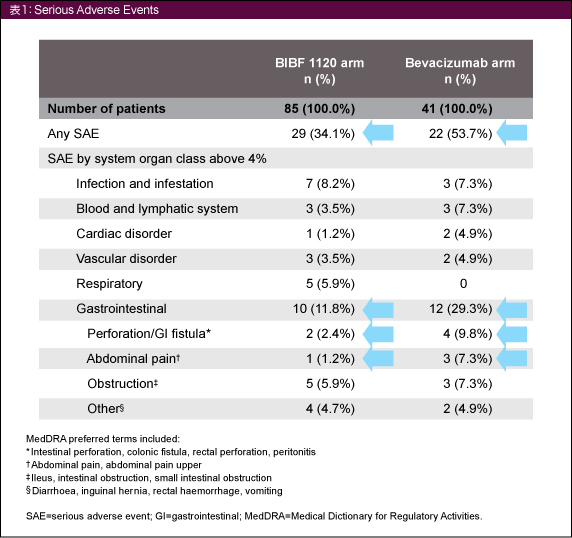
Grade 3以上の有害事象はBIBF 1120群で88%、Bevacizumab群で95%、重篤な有害事象 (serious adverse events: SAE) はそれぞれ34.1%、53.7%であり、いずれもBIBF 1120群のほうが少なかった (表1)。特に差がみられたのは胃腸障害のSAEで、全体ではBIBF 1120群11.8%、Bevacizumab群29.3%、個別の有害事象では消化管穿孔/瘻孔がそれぞれ2.4%、9.8%、腹痛が1.2%、7.3%であった。
5-FUを減量せずに12サイクル以上完遂した患者の割合と投与期間は、両群で差はみられなかった。一方、Oxaliplatinを減量せずに12サイクル以上完遂した患者の割合はBIBF 1120群で31.8%、Bevacizumab群では17.1%と、Bevacizumab群で低かった。
Grade 3以上の有害事象はBIBF 1120群で88%、Bevacizumab群で95%、重篤な有害事象 (serious adverse events: SAE) はそれぞれ34.1%、53.7%であり、いずれもBIBF 1120群のほうが少なかった (表1)。特に差がみられたのは胃腸障害のSAEで、全体ではBIBF 1120群11.8%、Bevacizumab群29.3%、個別の有害事象では消化管穿孔/瘻孔がそれぞれ2.4%、9.8%、腹痛が1.2%、7.3%であった。
BIBF 1120 + mFOLFOX6療法は、切除不能進行・再発大腸癌患者に対する1st-line治療において忍容可能な安全性を示し、抗腫瘍効果も有すると考えられた。Bevacizumabとの比較では有効性、mFOLFOX6のdose intensity、安全性プロファイルはほぼ同等であったが、SAEの発現頻度はBIBF 1120群で低く、特に消化管穿孔が少ない可能性が示唆された。本試験は進行中で、OSおよびQOLのデータを解析中である。
このサイトは医療関係者の方々を対象に作成しています。必ずご利用規約に同意の上、ご利用ください。記事内容で取り上げた薬剤の効能・効果および用法・用量には、日本国内で承認されている内容と異なるものが、多分に含まれていますのでご注意ください。

