背景と目的
EXPAND試験では、進行胃・胃食道接合部癌症例に対する1st-lineにおいて、抗EGFR 抗体薬のCetuximabを併用することが治療結果の改善につながらなかった1)。一方で、進行非小細胞肺癌の1st-lineにCetuximabを併用した場合、EGFR 高発現は生存の改善に関連していることが示唆されているが2)、胃癌におけるEGFR 発現レベルについては、まだ調べられていない。
HER2はEGFR と同様、受容体型チロシンキナーゼであり、HER2陽性胃癌では1st-lineにTrastuzumabを併用することで有意な生存の改善を認めている3)。HER2陽性は進行胃癌のいくつかの試験で予後不良と関連しているが4)、別の試験では、予後因子、治療効果予測因子としての意義は示されていない5)。
そこで今回、EXPAND試験の症例において、HER2 status別、EGFR 発現別の治療効果について検討した。
対象と方法
EXPAND試験は、局所進行・転移のある胃・胃食道接合部癌を対象とした国際非盲検無作為化第III相試験である。対象患者は、3週サイクルのCapecitabine + CDDPにCetuximabを併用する群 (CT + Cetuximab群) と、Capecitabine + CDDPのみを行う群 (CT群) に無作為に割り付けられた。
主要評価項目は独立判定のPFS (progression-free survival)、副次評価項目はOS (overall survival)、奏効率 (best overall response)であった。
HER2 statusは免疫組織染色 (Dako HercepTest) とFISHで胃癌の判定基準を用いて判定、EGFR の発現は免疫組織化学的染色 (Dako EGFR pharmaDx) で判定し、発現レベルをみるためにcontinuous scoring system (Scale of 0-300) を用いた。さらに、バイオマーカー解析として、探索的に治療効果との関係をみた。
結果
① HER2 statusによる解析
背景因子については、EXPANDのITT (904例) とHER2の評価を行った症例 (679例) で類似しており、治療群の間で差を認めなかった。一方、HER2陽性症例 (144例) とHER2陰性症例 (535例) の間では、性別、腫瘍の部位 (胃、胃食道接合部)、組織型、腹膜転移で差を認めた。
HER2 status別の治療転帰を表1、図1に示す。OS中央値は、HER2陽性症例のCT群で14.0ヵ月、CT + Cetuximab群で13.3ヵ月であり (HR=1.04)、HER2陰性症例ではCT群が9.7ヵ月、CT + Cetuximab群が9.2ヵ月であった (HR=0.98)。PFS中央値は、HER2陽性症例のCT群で6.9ヵ月、CT + Cetuximab群で5.6ヵ月 (HR=1.33)、HER2陰性症例のCT群で5.5ヵ月、CT + Cetuximab群で4.6ヵ月であった (HR=0.99)。
奏効率は、HER2陽性症例のCT群で37.5%、CT + Cetuximab群で51.4% (オッズ比1.76)、HER2陰性症例のCT群で26.4%、CT + Cetuximab群で27.0%であった (オッズ比1.03)。
Cetuximabによる治療効果の予測因子とはなっていないようであるが、いずれの治療群もHER2陽性症例の方がHER2陰性症例よりもOS中央値、奏効率が良好であった。
表1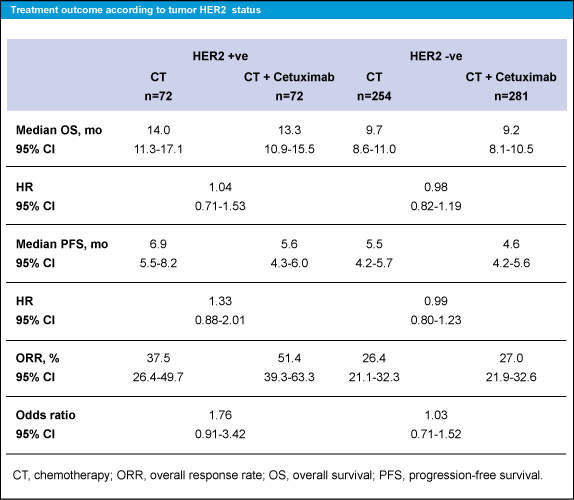
図1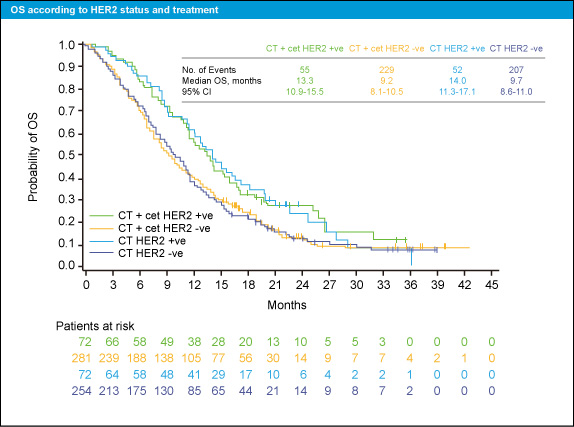
多変量解析では、HER2陰性症例はHER2陽性症例と比較して死亡のリスクが高かった (調整HR=1.55)。類似のモデルでは、HER2陰性症例はHER2陽性症例と比較し、奏効率のオッズ比でも減少を認めた (調整オッズ比 0.48)。
② EGFR 発現による解析
EGFR の発現は904症例中774症例で評価され (CT群376例、CT + Cetuximab群398例)、免疫染色スコアは全体的に低かった (中央値0、範囲0-300、75パーセンタイル40) (図2)。
図2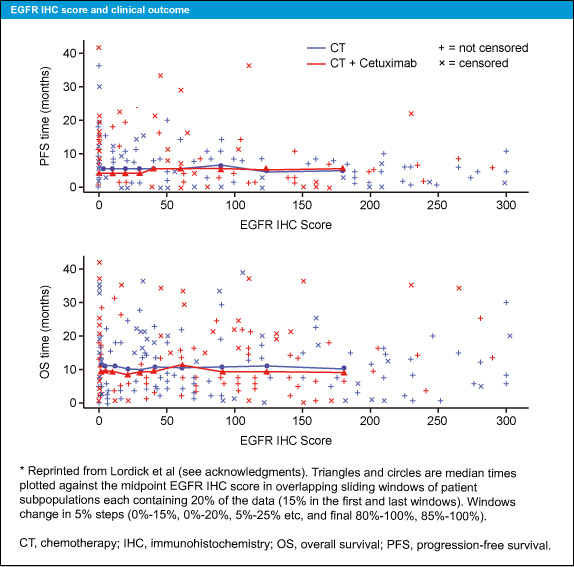
サブグループとして、免疫染色スコアを10毎に区切って解析すると、EGFR の免疫染色スコアが高くなるほど、CT + Cetuximab群でPFS、OSが良好である傾向がみられた (図3、4)。また、奏効率についても同様の傾向がみられた。ただし、このような傾向が認められるのは限られた症例で、免疫染色スコアが200以上の症例はCT + Cetuximab群の中の8例のみであった。このことからも、EGFR 免疫染色と転帰との関係は明らかではなかった。
図3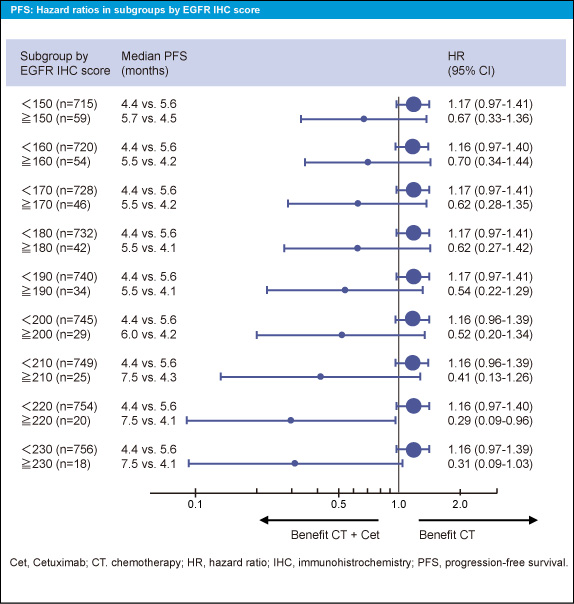
図4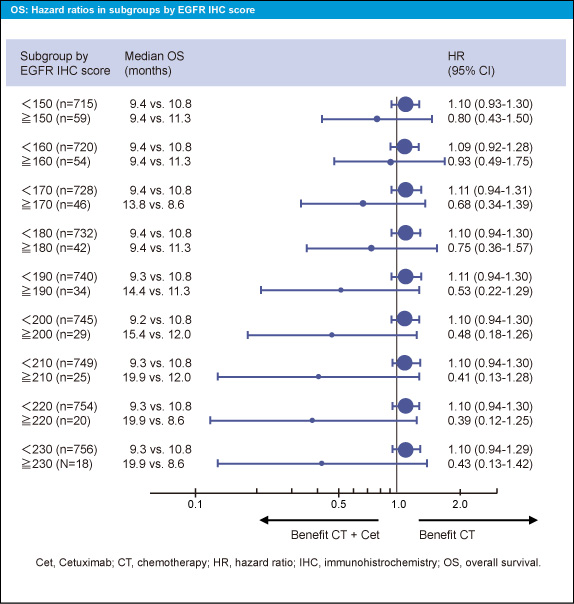
結論
EXPAND試験において、HER2陽性症例はHER2陰性症例と比較して、治療内容に関係なく治療成績が良好であった。したがって、予後因子としてのHER2 statusの意義について、本試験では明確な結論は出せない。EGFR 発現は全体的に低かった。
本試験は試験全体としてnegativeであったが、EGFR 高発現のような非常に限られた症例には治療効果があるかもしれない。
コメント
胃癌において、EGFR の発現は独立した予後因子と考えられており、EGFR を標的とした治療戦略に大きな期待が寄せられていた。しかし、最近報告された2つの臨床試験からは、抗EGFR 抗体薬の有効性は確認されなかった。
大腸癌と異なり、胃癌ではKRAS 変異の頻度が低いため、効果予測因子としてのEGFR の発現が注目されていた。しかし、今回のEXPAND試験のバイオマーカー解析では、EGFR 高発現そのものの頻度が低く、その関連は明確にされなかった。今後、遺伝子増幅や他の抗体を用いた解析に期待したい。
しかし、それにも増して興味深かったのは、HER2陽性症例において化学療法そのものの効果が高いことである。これは、同時に発表されていたMAGIC試験の遺伝子発現解析の結果6)でも同様で、周術期CT群でHER2陽性例は陰性例に対して有意に生存期間が延長していた。実は、同様の結果はJCOGの術前化学療法に関する試験でも経験されており、HER2陽性胃癌はもしかしたら化学療法高感受性かもしれない。ただし、ToGA試験の結果からはそのような傾向はみられないため、これも今後さらに検討を要する課題と思われた。
(レポート:坂東 英明 監修・コメント:寺島 雅典)
- Reference
-
- 1) Lordick F, et al.: Lancet Oncol. 14(6): 490-499, 2013 [PubMed]
- 2) Pirker R, et al.: Lancet Oncol. 13(1): 33-42, 2012 [PubMed]
- 3) Bang YJ, et al.: Lancet. 376(9742): 687-697, 2010 [PubMed]
- 4) Gravalos C, et al.: Ann Oncol. 19(9): 1523-1529, 2008 [PubMed]
- 5) Van Cutsem E, et al.: J Clin Oncol. 30(17): 2119-2127, 2012 [PubMed]
- 6) Lordick F, et al.: 2013 Annual Meeting of the American Society of Clinical Oncology®: abst #4020



