Abstract #4131
REAL3試験: 切除不能進行食道・胃癌 (OG癌) に対するEpirubicin + Oxaliplatin + Capecitabine (EOC) 療法 vs. modified (m) EOC + Panitumumab併用療法の多施設共同無作為化比較第II/III相試験-第II相試験における奏効率、毒性および遺伝子解析の結果
REAL3: A multicenter randomized phase II/III trial of epirubicin, oxaliplatin, and capecitabine (EOC) versus modified (m) EOC plus panitumumab (P) in advanced oesophagogastric (OG) cancer-Response rate (RR), toxicity, and molecular analysis from phase II.
Ian Chau, et al.

REAL2試験の結果から、Epirubicin + Oxaliplatin (L-OHP) + Capecitabine (EOC) 療法は切除不能進行食道・胃癌 (OG癌) の標準化学療法のひとつと認識されている1)。EGFRの発現はOG癌に高頻度でみられ、予後不良因子と考えられている。そのEGFRをターゲットとしたPanitumumabは、完全ヒト化IgG2モノクローナル抗体である。これまで、OG癌のKRAS 変異の発現頻度を検索した前向きの研究はなく、OG癌に対する化学療法におけるPanitumumabの効果は不明である。
REAL3試験は、切除不能進行OG癌患者におけるEOC + Panitumumab併用療法の効果を検討するために計画された第II/III相試験である。通常用量のEOC + Panitumumab併用療法ではgrade 3の下痢が早期に発現したことから、L-OHPとCapecitabineをそれぞれ100mg/m2、1,000mg/m2/dayに減量し、Epirubicin (50mg/m2) とPanitumumab (9mg/kg) を3週おきに投与する試験アーム [modified (m) EOC + Panitumumab] を設定し、mEOC + Panitumumab併用療法とEOC療法とを比較することになった。
今回は第II相試験の結果が報告された。
REAL3試験は、切除不能進行OG癌患者におけるEOC + Panitumumab併用療法の効果を検討するために計画された第II/III相試験である。通常用量のEOC + Panitumumab併用療法ではgrade 3の下痢が早期に発現したことから、L-OHPとCapecitabineをそれぞれ100mg/m2、1,000mg/m2/dayに減量し、Epirubicin (50mg/m2) とPanitumumab (9mg/kg) を3週おきに投与する試験アーム [modified (m) EOC + Panitumumab] を設定し、mEOC + Panitumumab併用療法とEOC療法とを比較することになった。
今回は第II相試験の結果が報告された。
適格基準は未治療のOG癌で、組織学的に腺癌または未分化癌と証明され、2方向で測定可能病変を有する症例である。なお、扁平上皮癌は除外した。
第II相試験の主要評価項目は、mEOC + Panitumumab群のRR (response rate) とした。
第II相試験の主要評価項目は、mEOC + Panitumumab群のRR (response rate) とした。
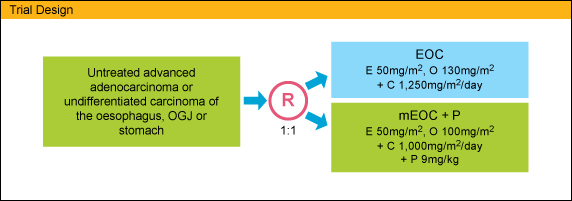
2009年4〜9月までに200人の患者が登録され、EOC群 (100例) またはmEOC + Panitumumab群 (100例) に無作為に割り付けられた。年齢中央値は 62歳、男性161例/女性39例、局所進行20例/転移・再発180例、食道83例/食道胃接合部57例/胃60例であった。
mECO + Panitumumab群のRRは52% (CR3%、PR49%) で、EOC群のRRは評価されなかった。
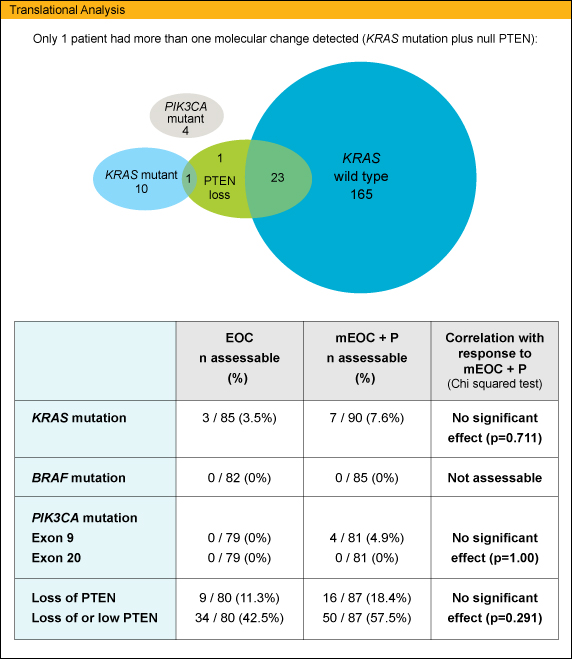
KRAS 変異型はEOC群で3.5% (3/85例)、mEOC + Panitumumab群では7.6% (7/90例) であり、mEOC + Panitumumab併用療法の治療効果との相関はみられなかった (p=0.771)。
mECO + Panitumumab群のRRは52% (CR3%、PR49%) で、EOC群のRRは評価されなかった。
KRAS 変異型はEOC群で3.5% (3/85例)、mEOC + Panitumumab群では7.6% (7/90例) であり、mEOC + Panitumumab併用療法の治療効果との相関はみられなかった (p=0.771)。
Grade 3以上の下痢はmEOC + Panitumumab群で24%、EOC群では15%にみられた。
主要評価項目であるmEOC + Panitumumab群のRRは52% (95%CI: 42-62%) であった。また、毒性は各薬剤の特性から既知のものであった。以上より第III相試験へ移行することになり、現在までに443例が登録されている。
未治療の切除不能進行食道・胃癌を対象としてEpirubicin + cisplatin + 5-FU (ECF) 療法、E + C + Capecitabine (ECX) 療法、 E + L-OHP + F (EOF) 療法および E + O + X (EOX) 療法の4 armsを比較するREAL2試験においては、EOX (EOC) 群が最も優れた成績を示した1)。欧州では、日・米・韓と異なりanthracycline系薬剤を含むレジメンが胃癌化学療法の中心である。
本演題は、無作為化比較第II/III試験として開始されたEOC療法に対するPanitumumabの上乗せ効果を検証するREAL3試験2)の続報である。Panitumumabの上乗せによりみられた有害事象は主としてgrade 3の下痢であり、そのためにPanitumumab併用群ではL-OHPが130mg/m2から100mg/m2に、Capecitabineが1,250mg/m2から1,000mg/m2に減量されている。それが、modified EOCと呼ばれている理由である。
第II相試験で検討された200例にみられたmEOC + Panitumumab群の有害事象は忍容できるものであった。なお、grade 3以上の下痢はmEOC + Panitumumab群で24%に、EOC群では15%に認められた。また、mEOC + Panitumumab群のRRは52%と良好なものであった。
一方、KRAS 遺伝子変異は5.7% (10/175例) にみられたのみであった。この値はこれまで報告されてきたものとほぼ同じであり、大腸癌とは異なる様相である3-5)。なお、REAL2で示されたEOC療法のRRは47.9%である。これはREAL3でのmEOC + Panitumumab療法のRR 52%と近似しており、両レジメンの有害事象もほぼ同等であった。ToGA、AVAGASTに続く胃癌に対する抗体製剤の有用性を検証する試験として、EXPANDとともに第III相試験の結果が待たれる。
本演題は、無作為化比較第II/III試験として開始されたEOC療法に対するPanitumumabの上乗せ効果を検証するREAL3試験2)の続報である。Panitumumabの上乗せによりみられた有害事象は主としてgrade 3の下痢であり、そのためにPanitumumab併用群ではL-OHPが130mg/m2から100mg/m2に、Capecitabineが1,250mg/m2から1,000mg/m2に減量されている。それが、modified EOCと呼ばれている理由である。
第II相試験で検討された200例にみられたmEOC + Panitumumab群の有害事象は忍容できるものであった。なお、grade 3以上の下痢はmEOC + Panitumumab群で24%に、EOC群では15%に認められた。また、mEOC + Panitumumab群のRRは52%と良好なものであった。
一方、KRAS 遺伝子変異は5.7% (10/175例) にみられたのみであった。この値はこれまで報告されてきたものとほぼ同じであり、大腸癌とは異なる様相である3-5)。なお、REAL2で示されたEOC療法のRRは47.9%である。これはREAL3でのmEOC + Panitumumab療法のRR 52%と近似しており、両レジメンの有害事象もほぼ同等であった。ToGA、AVAGASTに続く胃癌に対する抗体製剤の有用性を検証する試験として、EXPANDとともに第III相試験の結果が待たれる。
(レポート: 岩本 慈能 監修・コメント: 大村 健二)
Reference
1) Cunningham D, et al.: N Engl J Med. 358(1): 36-46, 2008 [PubMed]
2) Okines AF, et al.: J Clin Oncol. 28(25): 3945-3950, 2010 [PubMed]
3) Lordick F, et al.: Br J Cancer. 102(3): 500-505, 2010 [PubMed]
4) Pinto C, et al.: Br J Cancer. 101(8): 1261-1268, 2009 [PubMed]
5) Moehler M, et al.: Ann Oncol. 22(6): 1358-1366, 2011 [PubMed]
1) Cunningham D, et al.: N Engl J Med. 358(1): 36-46, 2008 [PubMed]
2) Okines AF, et al.: J Clin Oncol. 28(25): 3945-3950, 2010 [PubMed]
3) Lordick F, et al.: Br J Cancer. 102(3): 500-505, 2010 [PubMed]
4) Pinto C, et al.: Br J Cancer. 101(8): 1261-1268, 2009 [PubMed]
5) Moehler M, et al.: Ann Oncol. 22(6): 1358-1366, 2011 [PubMed]

このサイトは医療関係者の方々を対象に作成しています。必ずご利用規約に同意の上、ご利用ください。記事内容で取り上げた薬剤の効能・効果および用法・用量には、日本国内で承認されている内容と異なるものが、多分に含まれていますのでご注意ください。
