FOLFOXIRI±Bevacizumab
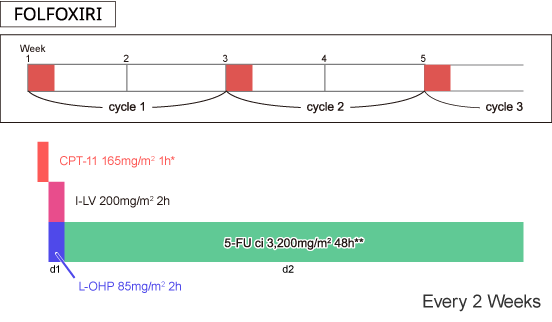 |
|
*CPT-11の日本での承認用量は150mg/m2 |
Falcone A, et al.: J Clin Oncol. 25(13): 1670-1676, 2007 |
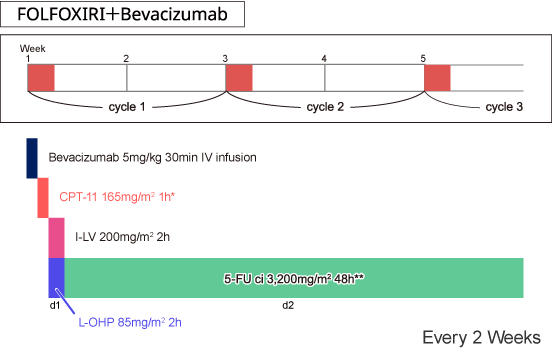 |
|
*CPT-11の日本での承認用量は150mg/m2 |
Loupakis F, et al.: N Engl J Med. 371(17): 1609-1618, 2014 |
FOLFOXIRIは、大腸癌における殺細胞性抗癌剤のkey drugである5-FU/LV、Oxaliplatin(L-OHP)、Irinotecan(CPT-11)をすべて併用するレジメンであり、FOLFOX、FOLFIRIを上回る治療法としてイタリアを中心に開発が進められた。本邦では、大腸癌治療ガイドライン2014年版より推奨レジメンとして掲載されている。
FOLFOXIRI
FOLFOXIRI+Bevacizumab
◆FOLFOXIRI(Falcone, et al.)
切除不能進行・再発大腸癌患者における1st-lineとして、FOLFIRIに対するFOLFOXIRIの有効性、安全性を検証する第III相試験が行われた1)。
適格症例244例が、FOLFOXIRI群とFOLFIRI群に1:1の割合で無作為化された。
■有効性
主要評価項目である外部評価による奏効率は、FOLFIRI群34%、FOLFOXIRI群60%であり、FOLFOXIRI群で有意に良好であった(p<0.0001)。また、副次評価項目であるPFS(p=0.0006)、OS(p=0.032)のいずれも有意な延長を認めた。
R0切除率は、FOLFIRI群6%、FOLFOXIRI群15%(p=0.033)、肝限局転移におけるR0切除率はそれぞれ12%、36%であり(p=0.017)、いずれもFOLFOXIRI群で有意に良好であった。
| FOLFOXIRI群 (n=122) |
FOLFIRI群 (n=122) |
HR (95% CI) |
P値 | |
| 奏効率 | 60% | 34% | − | <0.0001 |
| PFS中央値 | 9.8ヵ月 | 6.9ヵ月 | 0.63 (0.47-0.81) |
0.0006 |
| OS中央値 | 22.6ヵ月 | 16.7ヵ月 | 0.70 (0.50-0.96) |
0.032 |
■安全性
最も多くみられた有害事象は、好中球減少、下痢、悪心/嘔吐、口内炎、末梢神経障害、脱毛、血小板減少であったが、grade 3/4では好中球減少以外は少なかった。Grade 2/3の末梢神経障害(0% vs. 19%, p<0.0001)、grade 3/4の好中球減少(28% vs. 50%, p=0.0006)は有意にFOLFOXIRI群で高頻度であったが、発熱性好中球減少症は両群で同程度であった(3% vs. 5%, p=0.75)。
◆FOLFOXIRI+Bevacizumab(TRIBE試験)
切除不能進行・再発大腸癌患者における1st-lineとして、FOLFIRI+Bevacizumabに対するFOLFOXIRI+Bevacizumabの有効性、安全性を検証する第III相試験が行われた2)。
適格症例508例が、FOLFIRI+Bevacizumab群とFOLFOXIRI+Bevacizumab群に1:1の割合で無作為化された。
■有効性
主要評価項目であるPFS中央値は、FOLFIRI+Bevacizumab群9.7ヵ月、FOLFOXIRI+Bevacizumab群12.1ヵ月であり、FOLFOXIRI+Bevacizumab群で有意な延長を認めた(p=0.003)。副次評価項目である奏効率もFOLFOXIRI+Bevacizumab群で有意に良好であったが(p=0.006)、OSではFOLFOXIRI+Bevacizumab群で良好であったものの有意差を認めなかった(p=0.054)。
なお、追跡期間中央値48.1ヵ月における解析の結果、OS中央値はFOLFIRI+Bevacizumab群25.8ヵ月、FOLFOXIRI+Bevacizumab群29.8ヵ月であり、FOLFOXIRI+Bevacizumab群で有意な延長を認めた(p=0.03)3)。
| FOLFOXIRI+Bevacizumab群 (n=252) |
FOLFIRI群+Bevacizumab群 (n=256) |
HR (95% CI) |
P値 | |
| PFS中央値 | 12.1ヵ月 | 9.7ヵ月 | 0.75 (0.62-0.90) |
0.003 |
| 奏効率 | 65.1% | 53.1% | − | 0.006 |
| OS中央値 | 31.0ヵ月 | 25.8ヵ月 | 0.79 (0.63-1.00) |
0.054 |
■安全性
Grade 3/4の有害事象は、好中球減少(20.5% vs. 50.0%)、下痢(10.6% vs. 18.8%)、口内炎(4.3% vs. 8.8%)、末梢神経障害(0% vs. 5.2%)がFOLFOXIRI+Bevacizumab群で有意に多く認められたが、Bevacizumab関連有害事象は両群に有意差を認めなかった。また、重篤な有害事象も両群で同程度であった(19.7% vs. 20.4%)。
Reference
GI cancer-net
消化器癌治療の広場
