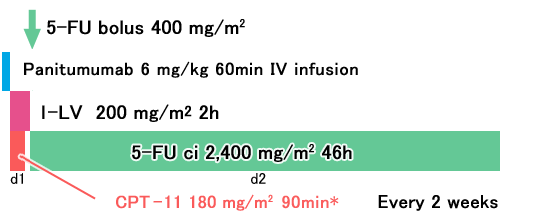
FOLFIRI+Panitumumab
 |
||
 |
||
*CPT-11の日本での承認用量は150mg/m2 |
||
Peeters M, et al.: ASCO-GI 2010, abst #282 |
Panitumumabは、米国アムジェン社(旧Abgenix社、Immunex社)がXenomouse®技術を用いて開発した高親和性のIgG2サブクラスのヒト型モノクローナル抗体である。PanitumumabはEGFRに結合し、内在性リガンドのEGFRへの結合と、その後に続くEGFRを介したシグナル伝達を阻害することで、腫瘍の増殖を抑制すると考えられている。
欧米では、2006年9月(米国)および2007年12月(EU)に承認された。本邦においては、2010年4月「KRAS遺伝子野生型の治癒切除不能な進行・再発の結腸・直腸癌」を対象に、一次治療、二次治療、三次治療以降の治療薬として承認された。
◆20050181試験
フルオロウラシル系薬剤を含む化学療法不応の切除不能進行再発大腸癌患者に対する2nd-lineとしてのFOLFIRI+Panitumumab併用療法とFOLFIRI単独療法を比較した無作為化比較試験である。本試験は、日本を含む国際共同第III相試験として実施された。
PRIME試験(FOLFOX+Panitumumab参照)と同様、3rd-lineとしてのPanitumumabの第III相試験(20020408試験)のサブ解析結果を受けてプロトコルが改訂され、KRAS status別にプロスペクティブな評価が行われた。
■有効性
主要評価項目であるKRAS 野生型患者におけるprogression-free survival(PFS)の中央値は、FOLFIRI+Panitumumab群が5.6ヵ月、FOLFIRI群が3.3ヵ月であり、Panitumumab併用群において有意な延長が認められた1)。
Overall survival(OS)の中央値は各々14.5ヵ月、12.5ヵ月であり、Panitumumab併用群で良好な傾向にあった。また、奏効率は35%、10%であり、Panitumumab併用群において有意な改善が認められた(p<0.001)(ともにKRAS 野生型)。
| KRAS 野生型(n=597) | KRAS 変異型(n=486) | |||||||
|---|---|---|---|---|---|---|---|---|
| Panitumumab +FOLFIRI (n=303) |
FOLFIRI (n=294) |
p値 | HR (95% CI) |
Panitumumab +FOLFIRI (n=238) |
FOLFIRI (n=248) |
p値 | HR (95% CI) |
|
| PFS中央値 (月) |
5.9 | 3.9 | 0.004 | 0.73 (0.59-0.90) |
5.0 | 4.9 | 0.14 | 0.85 (0.68-1.06) |
| OS中央値 (月) |
14.5 | 12.5 | 0.12 | 0.85 (0.70-1.04) |
11.8 | 11.1 | 0.55 | 0.94 (0.76-1.15) |
| 奏効率 | 35% | 10% | <0.001 | 13% | 14 % | 1.0 | ||
■安全性
KRAS 野生型におけるGrade 3/4の有害事象の発現頻度はFOLFIRI+Panitumumab群 vs. FOLFIRI群=68% vs. 43%、重篤な有害事象は41% vs. 31%、致死的な有害事象は4% vs. 6%であった(病勢進行による死亡例を含む)2)。最終報告におけるGrade 3/4の各有害事象の発現頻度は下表の通りである3)。
Reference
- 1) Peeters M, et al.: ASCO-GI 2010, abst #282[ASCO abstract][ASCO-GI 2010レポート]
- 2) Peeters M, et al.: J Clin Oncol. 28(31): 4706-4713, 2010 [PubMed]
- 3) Sobrero AF, et al.: ASCO GI cancers symposium 2012: abst #387 [ASCO abstracts][ASCO-GI 2012レポート]
- 副作用対策講座「皮膚障害-1 分子標的薬の皮膚障害」
- 副作用対策講座「下痢」
GI cancer-net
消化器癌治療の広場
