丂忋旂惉挿場巕庴梕懱 (epidermal growth factor receptor: EGFR) 偼丄惓忢慻怐偱偼嵶朎暘壔傗憹怋丄堐帩偵廳梫側栶妱傪壥偨偟偰偄傞堦曽偱丄娻慻怐偵偍偄偰傕憹怋傗怹弫丄揮堏偵嫮偔娭梌偟丄戝挵娻偺60-80%偱EGFR偺崅敪尰傪擣傔傞丅EGFR偵EGF丄TGF-兛側偳偺儕僈儞僪偑寢崌偡傞偲丄嵶朎撪僠儘僔儞僉僫乕僛僪儊僀儞偑帺屓儕儞巁壔偟丄偝傜偵壓棳傊偺僔僌僫儖揱払宱楬偑妶惈壔偝傟傞丅偦偺偨傔丄EGFR傪昗揑偲偟偨峈懱栻偍傛傃僠儘僔儞僉僫乕僛慾奞嵻偺椪彴奐敪偑峴傢傟偰偒偨丅
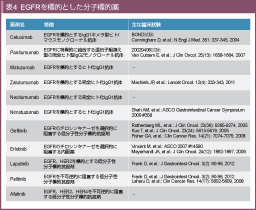
丂Cetuximab偼EGFR傪昗揑偲偡傞IgG1僉儊儔宆僸僩/儅僂僗儌僲僋儘乕僫儖峈懱偱偁傞丅Cetuximab偱偼扨撈搳梌傑偨偼CPT-11丄Cisplatin (CDDP)丄5-FU側偳條乆側嵶朎彎奞惈峈娻嵻偲偺暪梡偵偍偄偰峈庮釃岠壥偑庬乆偺僸僩庮釃堏怉儌僨儖偱妋擣偝傟丄1994擭偐傜椪彴帋尡偑奐巒偝傟偨丅屌宍娻傪懳徾偵丄Cetuximab扨夞搳梌 (5乣100mg/m2)丄廡1夞楢懕搳梌 (5乣100mg/m2)丄CDDP暪梡椕朄 (Cetuximab搳梌検5乣400mg/m2) 偺戞I憡帋尡偑峴傢傟丄Cetuximab偺僋儕傾儔儞僗偑朞榓偵払偡傞搳梌検偼200mg/m2埲忋丄廡1夞搳梌偱偁偭偨52)丅傑偨丄摢栩晹娻傪懳徾偵Cetuximab偲曻幩慄椕朄丄CDDP偲偺暪梡椕朄傪専摙偟偨戞I憡帋尡偱偼丄Cetuximab偺搳梌検傪弶夞100乣500mg/m2丄2廡栚埲崀100乣250mg/m2偱憹検偟偰峴傢傟偨丅弶夞搳梌検傪400mg/m2丄偦偺屻偺堐帩搳梌検傪250mg/m2偱廡1夞斀暅搳梌偡傞搳梌朄 (400/250朄) 偵偍偄偰庮釃慻怐偱偺EGFR偑Cetuximab偵傛偭偰廫暘朞榓偝傟偰偄偨偙偲丄500/250mg/m2偺梡検偱偼旂晢撆惈偺敪尰昿搙偑崅偐偭偨偙偲摍偑峫椂偝傟丄埲屻偺帋尡偱偼400/250朄偑嵦梡偝傟傞偙偲偲側偭偨53)丅
丂EGFR梲惈屌宍娻傪懳徾偵偟偨CPT-11 + Cetuximab椕朄偺戞I憡帋尡偱偼CPT-11暪梡偵傛傞PK偺曄壔偼擣傔傜傟偢丄慜椪彴帋尡偵偰丄CPT-11懴惈戝挵娻嵶朎姅偵懳偡傞CPT-11 + Cetuximab椕朄偺桳岠惈偑擣傔傜傟偨偙偲偐傜丄CPT-11 + Cetuximab椕朄偺戞II憡帋尡偑峴傢傟偨54)丅EGFR梲惈偱CPT-11晄墳偺戝挵娻138椺傪懳徾偲偟偰CPT-11 + Cetuximab椕朄偑峴傢傟丄憈岠棪 15%丄TTP拞墰抣2.9儠寧偲椙岲側寢壥偱偁偭偨丅偝傜偵丄CPT-11晄墳椺偵懳偡傞Cetuximab扨撈椕朄偲CPT-11 + Cetuximab椕朄偲傪斾妑偡傞柍嶌堊壔斾妑戞II憡帋尡偑峴傢傟 (BOND帋尡)丄憈岠棪偼Cetuximab扨撈孮10.8%丄CPT-11暪梡孮22.9%偲CPT-11暪梡偵傛傞桳堄側忋忔偣岠壥傪擣傔 (p=0.007)丄PFS拞墰抣傕Cetuximab扨撈孮1.5儠寧丄CPT-11暪梡孮4.1儠寧偲Cetuximab孮偱桳堄偵椙岲偱偁偭偨 (HR=0.54, p<0.001) 55)丅埲忋偺寢壥偐傜丄暷崙FDA偼2004擭2寧偵EGFR梲惈偺CPT-11掞峈惈戝挵娻偵懳偟偰Cetuximab扨撈偍傛傃CPT-11 + Cetuximab椕朄傪彸擣偟偨丅偦偺屻丄BOND帋尡偺屻夝愅偵偍偄偰庮釃偺EGFR敪尰搙崌偲憈岠棪偵憡娭偑擣傔傜傟側偄偙偲偑暘偐傝丄尰嵼偱偼EGFR敪尰偺桳柍偼Cetuximab偺岠壥梊應場巕偱偼側偄偲峫偊傜傟偰偄傞丅
丂Panitumumab偼丄EGFR偵摿堎揑偵寢崌偡傞堚揱巕慻姺偊宆偺姰慡僸僩宆IgG2儌僲僋儘乕僫儖峈懱偱偁傝丄奐敪攚宨偵偼姰慡僸僩宆峈懱傪嶌惉偡傞媄弍偺恑曕偑偁偭偨丅婎慴幚尡偱偼丄EGFR偺嵶朎奜僪儊僀儞III偵寢崌偟丄Cetuximab偲斾妑偟偰栺8攞恊榓惈偑崅偄偙偲偑帵偝傟偰偄傞56)丅2000擭偐傜奐巒偝傟偨梡検慟憹戞嘥憡帋尡偱偼丄Panitumumab偺搳梌検1.0丄1.5丄2.0丄2.5mg/kg/week偲憹検偝傟丄2.5mg/kg傪搳梌偟偨21椺偵偍偄偰丄嵟戝懴惈検偱偼側偄傕偺偺栻椡妛揑儅乕僇乕偲峫偊傜傟傞旂怾偑100%擣傔傜傟偨偙偲丄僩儔僼抣偑堎庬堏怉娻儌僨儖偱偺IC90傪挻偊偰偄偨偙偲偐傜丄2.5mg/kg偺廡1夞搳梌偑帄揔梡検偲寛掕偝傟偨57)丅偝傜偵丄Panitumumab偺敿尭婜偑5-9擔偲斾妑揑挿偄偙偲偐傜丄2廡枅丄3廡枅偺搳梌朄偑専摙偝傟丄偦傟偧傟6.0mg/kg 2廡枅丄9.0mg/kg 3廡枅偑揔愗偱偁傞偲寛掕偝傟偨58)丅傑偨丄偦傟偧傟偺搳梌朄偱偺弶夞搳梌屻偺僩儔僼擹搙偼愭偺IC90抣埲忋偱偁偭偨偙偲偐傜丄弶夞晧壸搳梌偼晄梫偲敾抐偝傟偨丅戞I憡帋尡偱偺扵嶕揑側峈庮釃岠壥偺専摙偵偰丄憈岠椺偺傎偲傫偳偑戝挵娻偱偁偭偨偙偲偐傜丄埲屻偺帯椕奐敪偼戝挵娻傪桪愭偲偟偰峴傢傟偨丅
丂CPT-11偍傛傃L-OHP晄墳偺EGFR梲惈戝挵娻姵幰偵懳偟偰best supportive care (BSC) 偲Panitumumab椕朄偲傪斾妑偡傞戞III憡帋尡 (20020408帋尡) 偑峴傢傟丄庡梫昡壙崁栚偺PFS偼拞墰抣偑BSC孮7.3廡丄Panitumumab孮8.0廡偲丄Panitumumab孮偱椙岲偱偁偭偨 (HR=0.54, 95% CI: 0.44-0.66, p<0.0001) 59)丅OS偱偼椉孮偵嵎傪擣傔側偐偭偨偑 (p=0.81)丄BSC孮偺76%偑屻帯椕偲偟偰Panitumumab椕朄偺戞II憡帋尡偵搊榐偝傟偰偄偨丅偙偺寢壥傪庴偗偰丄Panitumumab偼2006擭9寧偵FDA偱彸擣偝傟偨丅偦偺屻丄463椺拞427椺 (92%) 偱Allele-specific PCR朄偵傛傞KRAS堚揱巕夝愅偑峴傢傟偨寢壥丄KRAS曄堎宆 (43%) 偱偼PFS偵桳堄嵎傪擣傔側偐偭偨偺偵懳偟 (HR 0.99)丄KRAS栰惗宆 (57%) 偵偍偗傞PFS拞墰抣偼丄BSC孮7.3廡丄Panitumumab孮12.3廡偲丄Panitumumab孮偱桳堄偵椙岲偱偁偭偨 (HR=0.45, p<0.0001) 60)丅偦偺懠丄Cetuximab偍傛傃Panitumumab傪梡偄偨戞III憡帋尡偺屻夝愅偐傜丄峈EGFR峈懱栻偺椪彴岠壥偼KRAS曄堎宆偵偼擣傔傜傟側偄偙偲偑柧傜偐偲側偭偨丅偦偺偨傔丄2009擭6寧丄暷崙FDA偼Cetuximab丄Panitumumab偺揧晅暥彂偵乽峈EGFR峈懱栻偺巊梡偼codon 12傑偨偼13偺KRAS堚揱巕曄堎偑偁傟偽姪傔傜傟側偄乿偲捛婰偡傞偙偲傪彸擣偟偰偄傞丅
丂Matuzumab (EMD72000) 偼EGFR偵懳偡傞僸僩壔IgG1峈懱偱偁傞丅戝挵娻丄堓娻丄旕彫嵶朎攛娻傪懳徾偵椪彴奐敪偑恑傔傜傟偨偑丄婜懸偡傞傎偳偺岠壥偑摼傜傟偢丄2008擭偵奐敪拞巭偲側偭偨丅
丂Zalutumumab (HuMax-EGFr) 偼姰慡僸僩壔IgG1峈懱偱偁傞丅摢栩晹滸暯忋旂娻傪懳徾偵戞III憡帋尡偑峴傢傟偨偑丄桳岠惈偑徹柧偝傟偢61)丄2011擭奐敪偑拞巭偝傟偨丅
丂Necitumumab (IMC-11F8) 偼EGFR偵懳偡傞姰慡僸僩壔IgG1峈懱偱偁傞丅旕彫嵶朎攛娻丄摿偵滸暯忋旂娻傪懳徾偵椪彴奐敪偑恑傫偱偄傞丅戝挵娻偵懳偟偰偼弶夞帯椕偵偍偗傞mFOLFOX6 + Necitumumab偺戞II憡帋尡偑峴傢傟偰偄傞62)丅
丂Nimotuzumab (h-R3) 偼EGFR偵懳偡傞僸僩壔IgG1峈懱偱偁傞丅EGFR傊偺恊榓惈偑傗傗庛偔娻嵶朎偵斾妑偟偰惓忢旂晢傊偺寢崌偑庛偄偨傔丄桳奞帠徾偲偟偰偺旂怾偑摨宯摑偺栻嵻偲斾妑偟偰寉搙偱偁傞丅CPT-11晄墳戝挵娻偵偍偗傞CPT11 + Nimotuzumab椕朄偺戞II憡帋尡偑峴傢傟偨偑憈岠棪3.4%偲丄婜懸偝傟偨岠壥偼摼傜傟側偐偭偨63)丅尰嵼丄摢栩晹娻丄旕彫嵶朎攛娻丄堓娻側偳傪懳徾偲偟偨椪彴奐敪偑桪愭偝傟偰偄傞丅
丂戝挵娻嵶朎姅堏怉摦暔儌僨儖傪梡偄偨婎慴幚尡偵偰VEGF慾奞嵻偲峈EGFR峈懱栻偵傛傝憡忔揑側峈庮釃岠壥偑擣傔傜傟偨偙偲偐傜64)丄VEGF慾奞嵻偲峈EGFR峈懱栻偲偺暪梡椕朄偑帋傒傜傟偨丅CPT-11晄墳偺戝挵娻傪懳徾偵CPT-11 + Cetuximab + Bevacizumab椕朄偲Cetuximab + Bevacizumab椕朄偲傪斾妑偟偨柍嶌堊壔戞II憡帋尡 (BOND-2帋尡) 偱偼丄CPT-11暪梡孮偱憈岠棪37%丄TTP拞墰抣7.3儠寧偱偁傝65)丄BOND帋尡偵偍偗傞CPT-11 + Cetuximab椕朄偺惉愌 (憈岠棪22.9%丄TTP拞墰抣4.1儠寧) 傛傝傕椙岲側孹岦偱偁偭偨55)丅
丂堦曽偱丄戝挵娻弶夞帯椕椺偵懳偡傞Bevacizumab偲峈EGFR峈懱栻偲偺暪梡偵娭偟偰偼丄2偮偺戞III憡帋尡偑峴傢傟偰偄傞丅XELOX + Bevacizumab椕朄偲XELOX + Bevacizumab + Cetuximab椕朄偲傪斾妑偟偨戞III憡帋尡 (CAIRO2帋尡) 偱偼丄庡梫昡壙崁栚偺PFS偵偍偄偰拞墰抣10.7儠寧 vs. 9.4儠寧 (HR=1.22, p=0.01) 偲Cetuximab暪梡孮偱桳堄偵楎偭偰偄偨66)丅傑偨丄KRAS栰惗宆偵尷掕偟偨夝愅偵偍偄偰傕PFS (p=0.30)丄OS (p=0.64)偲丄偄偢傟傕Cetuximab偺忋忔偣岠壥傪擣傔側偐偭偨丅偝傜偵丄CPT-11傕偟偔偼L-OHP儀乕僗偺壔妛椕朄 + Bevacizumab椕朄偵懳偡傞Panitumumab偺忋忔偣岠壥傪専摙偟偨戞III憡帋尡 (PACCE帋尡) 偑峴傢傟偨偑丄拞娫夝愅偵偰庡梫昡壙崁栚偱偁傞PFS偑Panitumumab暪梡孮偱桳堄偵楎偭偰偄偨偨傔 (HR=1.44, p=0.004)丄搊榐拞巭偲側偭偨67)丅偙傟傜偺寢壥傪庴偗丄摉帪峴傢傟偰偄偨峈EGFR峈懱栻偲Bevacizumab傪捈愙斾妑偡傞戞III憡帋尡 (弶夞帯椕: CALGB80405帋尡丄2nd-line: SWOG0600帋尡) 偵偍偄偰丄椉幰傪暪梡偡傞帯椕孮偼搊榐拞巭偲側偭偨丅
丂CAIRO2帋尡丄PACCE帋尡偱峈EGFR峈懱栻暪梡孮偺桳岠惈偑擣傔傜傟側偐偭偨梫場偼柧傜偐偱偼側偄丅撆惈偵娭偟偰偼峈EGFR峈懱栻偵傛傞旂怾傗壓棢偺憹嫮偼擣傔傜傟傞傕偺偺丄5-FU傗L-OHP偺DI偼峈EGFR峈懱栻暪梡偺桳柍偱戝偒側堘偄偼側偄偲曬崘偝傟偰偄傞丅傓偟傠丄峈EGFR峈懱栻偲Bevacizumab偲偺憡惈偺埆偝偑尨場偱偁傞偲峫偊傜傟偰偍傝丄幚嵺丄Bevacizumab暪梡偵偍偄偰丄庮釃偺Cetuximab偺庢傝崬傒偑42%傕掅壓偡傞偲偄偆曬崘傕偝傟偰偄傞68)丅
丂Gefitinib偼EGFR偺僠儘僔儞僉僫乕僛傪慖戰揑偵慾奞偡傞掅暘巕惈暘巕昗揑峈娻嵻偱偁傞丅杮朚偱1998擭偵屌宍娻傪懳徾偵峴傢傟偨戞I憡帋尡 (1擔1夞搳梌2廡撪暈2廡媥栻) 偱偼丄旕彫嵶朎攛娻23椺丄戝挵娻5椺傪娷傓31椺偑搊榐偝傟偨丅700mg偺搳梌検儗儀儖偵偍偄偰grade 3偺DLT偑6椺拞2椺 (壓棢丄ALT憹壛) 偵擣傔傜傟偨偨傔丄MTD偼700mg偲寛掕偝傟偨69)丅側偍丄5椺偵憈岠傪擣傔偨偑丄慡椺偑旕彫嵶朎攛娻偱偁偭偨丅傑偨丄僾儔僠僫惢嵻傪娷傓慜帯椕楌偺偁傞旕彫嵶朎攛娻傪懳徾偵偟偨Gefitinib (250丄500mg/day) 偺柍嶌堊壔戞II憡帋尡偱偼丄椉孮偺憈岠棪偼傎傏摨摍 (18.4% vs. 19.0%) 偱偁偭偨偑丄旂怾丄壓棢丄娞婡擻忈奞偺撆惈昿搙偼500mg孮偱崅偐偭偨70)丅傛偭偰丄埲屻偺旕彫嵶朎攛娻偱偺奐敪偼搳梌検250mg/day偱奐敪偝傟丄杮朚偱偼2002擭丄暷崙偱偼2003擭偵彸擣偝傟偨丅
丂堦曽丄慜椪彴帋尡偵偍偄偰Gefitinib偼戝挵娻嵶朎姅偵懳偟偰傕峈庮釃岠壥傪桳偟丄嶦嵶朎惈峈娻嵻偲偺憡忔岠壥偑曬崘偝傟偰偄偨丅偟偐偟丄5-FU + CPT-11偺慜帯椕楌偺偁傞戝挵娻115椺傪懳徾偵峴傢傟偨Gefitinib扨嵻椕朄 (250丄500mg) 偺戞II憡帋尡偱偼丄憈岠椺偼500mg孮偺1椺偺傒偱偁傝 (憈岠棪1%)丄PFS拞墰抣1.9儠寧丄OS拞墰抣6.3儠寧偱偁偭偨71)丅傑偨丄慜帯椕楌偺偁傞戝挵娻28椺傪懳徾偵Gefitinib傪750mg/day偵憹検偟偨戞II憡帋尡偱偼丄憈岠椺傪擣傔側偐偭偨72)丅Kuo傜偼慜帯椕楌偺偁傞27椺傪懳徾偵丄FOLFOX4 + Gefitinib (500mg) 椕朄偺戞II憡帋尡傪峴偄丄憈岠棪33%丄EFS (event-free survival) 拞墰抣5.4儠寧丄OS拞墰抣12.0儠寧偲曬崘偟偰偄傞73)丅Fisher傜偼弶夞帯椕偵偍偗傞FOLFOX4 + Gefitinib (500mg) 椕朄偺戞II憡帋尡 (45椺) 偵偍偄偰丄憈岠棪72%丄TTP拞墰抣 9.3儠寧丄OS拞墰抣20.5儠寧偲曬崘偟偰偄傞74)丅偄偢傟偺帋尡傕岠壥偼斾妑揑椙岲偱偁偭偨偑丄grade 3/4偺壓棢偑48乣67%丄岲拞媴尭彮偑48乣60%偲桳奞帠徾偼擡梕偱偒傞傕偺偱偼側偐偭偨丅傑偨丄CPT-11偲偺暪梡椕朄傕丄偄偔偮偐偺戞I/II憡帋尡偑曬崘偝傟偰偄傞丅弶夞帯椕偵偍偗傞FOLFIRI椕朄偲FOLFIRI + Gefitinib (250mg) 椕朄偲傪斾妑偟偨柍嶌堊壔戞II憡帋尡偱偼丄憈岠棪偼FOLFIRI孮47.9%丄Gefitinib暪梡孮45.1%丄PFS拞墰抣偼偦傟偧傟8.3儠寧丄8.3儠寧丄OS拞墰抣偼18.6儠寧丄17.1儠寧偲嵎傪擣傔偢丄grade 3/4偺壓棢偼偦傟偧傟2.1%丄33.3%偲桳堄偵Gefitinib暪梡孮偱懡偐偭偨75)丅埲忋偐傜丄戝挵娻偵懳偡傞Gefitinib偼丄扨嵻偱偼岠壥偑晄廫暘偱偁傝丄嵶朎彎奞惈峈娻嵻偲偺暪梡偱偼廳撃側壓棢摍偺桳奞帠徾偺憹壛傪擣傔偨丅
丂Erlotinib傕Gefitinib摨條偵EGFR偺僠儘僔儞僉僫乕僛傪慖戰揑偵慾奞偡傞撪暈栻偱偁傝丄暷崙傪拞怱偵奐敪偑恑傔傜傟偨丅屌宍娻傪懳徾偵偟偨戞I憡帋尡偵偰丄200mg孮偱6椺拞2椺偵DLT (grade 3/4偺壓棢) 偑擣傔傜傟丄悇彠梡検偼150mg/day偲寛掕偝傟偨76)丅偦偟偰丄慜帯椕楌偺偁傞旕彫嵶朎攛娻傪懳徾偵placebo孮偲偺戞III憡帋尡偵偰桳堄側惗懚婜娫墑挿傪帵偟 (p<0.001) 77)丄2004擭偵暷崙偱彸擣偝傟偨丅
丂戝挵娻偵偍偄偰偼丄婛帯椕椺偺戝挵娻傪懳徾偵偟偨Erlotinib (150mg) 扨嵻椕朄偺戞II憡帋尡偑峴傢傟偨偑丄憈岠棪偼0%偱偁偭偨78)丅傑偨丄弶夞帯椕椺傪懳徾偵丄Capecitabine扨撈椕朄丄Capecitabine + Erlotinib椕朄丄Erlotinib扨撈椕朄偺3孮傪斾妑偡傞柍嶌堊壔戞II憡帋尡偱偼丄Erlotinib扨撈孮偼惉愌晄椙偺偨傔搑拞偱搊榐拞巭偲側傝丄Capecitabine扨撈孮偲Erlotinib暪梡孮偲偺斾妑偵偍偄偰憈岠棪丄TTP丄OS偵桳堄嵎傪擣傔側偐偭偨79)丅堦曽丄桳奞帠徾偺昿搙偼Capecitabine扨撈孮偲斾妑偟偰Erlotinib暪梡孮偱崅偐偭偨丅L-OHP偲Erlotinib偺暪梡傕偄偔偮偐曬崘偑偝傟偰偄傞丅Meyerhardt傜偵傛傞戝挵娻婛帯椕椺32椺傪懳徾偲偟偨XELOX + Erlotinib (150mg) 椕朄偺戞II憡帋尡偱偼丄憈岠棪25%丄PFS拞墰抣5.4儠寧偲帯椕惉愌偼椙岲偱偁偭偨80)丅偟偐偟丄grade 3/4偺桳奞帠徾偲偟偰壓棢38%丄埆怱丒歲揻19%丄旀楯16%丄旂怾13%偑擣傔傜傟丄擡梕偱偒傞偲偼尵偄擄偄撆惈僾儘僼傽僀儖偱偁偭偨丅FOLFIRI偲Erlotinib偺暪梡椕朄偱傕丄戞I憡帋尡偱愝掕偝傟偨嵟彫搳梌検偵偍偄偰旂怾丄壓棢丄岲拞媴尭彮偑DLT偲偟偰弌尰偟偰偄偨偨傔丄FOLFIRI偲偺暪梡椕朄偼擡梕偱偒側偄偲峫偊傜傟偨丅
丂弶夞帯椕屻偺堐帩椕朄偲偟偰Bevacizumab扨撈椕朄偲Bevacizumab + Erlotinib暪梡椕朄偲傪斾妑偟偨戞III憡帋尡 (GERCOR DREAM帋尡) 偱偼丄庡梫昡壙崁栚偱偁傞堐帩椕朄偵偍偗傞PFS偺拞墰抣偑Bevacizumab孮4.57儠寧丄Erlotinib暪梡孮5.75儠寧偲丄Erlotinib暪梡孮偱桳堄偵椙岲偱偁偭偨 (HR=0.73, 95% CI: 0.59-0.91, p=0.0050) 81)丅Grade 3埲忋偺壓棢 (1% vs. 9%)丄旂晢撆惈 (0% vs. 20%) 偺昿搙偑Erlotinib暪梡孮偱懡偐偭偨偑丄擡梕壜擻偱偁傞偲峫偊傜傟偨丅Bevacizumab扨嵻偵懳偟偰偱偼偁傞傕偺偺Bevacizumab + Erlotinib椕朄偑堦掕偺岠壥傪帵偟偨偙偲偼昡壙偱偒傞偑丄戝挵娻偵偍偄偰Bevacizumab扨嵻偑昗弨帯椕偲偼擣幆偝傟偰偄側偄偙偲丄堐帩椕朄偺PFS偑庡梫昡壙崁栚偲偟偰懨摉偱偁傞偐偳偆偐側偳丄杮帯椕偺椪彴揑堄媊偼柧妋偵偼側偭偰偄側偄丅
丂Lapatinib偼EGFR丄HER2傪昗揑偲偡傞掅暘巕惈暘巕昗揑峈娻嵻偱偁傝丄in vitro偱偺IC50偼偦傟偧傟10.8nM, 9.2nM偲曬崘偝傟偰偍傝82)丄尰嵼丄HER2梲惈擕娻傪懳徾偵揔墳彸擣偑摼傜傟偰偄傞丅戝挵娻偵懳偟偰偼EGFR慾奞岠壥傪婜懸偟偰偄偔偮偐椪彴帋尡偑峴傢傟偰偄傞偑丄5-FU丄CPT-11丄L-OHP晄墳偺戝挵娻姵幰傪懳徾偵偟偨Capecitabine + Lapatinib椕朄偺戞II憡帋尡偱偼丄憈岠椺傪擣傔偢岠壥偼摼傜傟側偐偭偨偲曬崘偝傟偰偄傞83)丅Lapatinib偼尰嵼丄摢栩晹娻傗HER2夁忚敪尰堓娻傪懳徾偲偟偨戞III憡帋尡偑峴傢傟偰偍傝丄戝挵娻偵懳偡傞帯椕奐敪偼恑傫偱偄側偄丅
丂Pelitinib (EKB-569) 偼EGFR傪晄壜媡揑偵慾奞偡傞掅暘巕惈暘巕昗揑峈娻嵻偱偁傞丅戝挵娻傪懳徾偵Capecitabine傗FOLFIRI偲偺暪梡椕朄偺戞I憡帋尡偑峴傢傟偨偑84, 85)丄2009擭偵奐敪婇嬈偱偁偭偨儚僀僗偑僼傽僀僓乕幮偵攦廂偝傟偨偺傪宊婡偵丄EKB-569偼奐敪拞巭偲側偭偰偄傞丅側偍丄僼傽僀僓乕幮偼EGFR丄HER2丄HER4偵懳偡傞晄壜媡揑慾奞嵻偱偁傞Dacomitinib (PF-00299804) 傪庡偵EGFR曄堎梲惈偺旕彫嵶朎攛娻傪懳徾偲偟偰椪彴奐敪傪恑傔偰偄傞丅
丂Afatinib (BIBW2992) 偼EGFR丄HER2丄HER4傪晄壜媡揑偵慾奞偡傞掅暘巕惈暘巕昗揑峈娻嵻偱偁傞丅尰嵼丄EGFR曄堎梲惈旕彫嵶朎攛娻丄HER2梲惈擕娻丄摢栩晹娻傪懳徾偵戞III憡帋尡偑峴傢傟偰偄傞丅傑偨丄戝挵娻偵懳偟偰傕丄Afatinib扨嵻椕朄偺戞II憡偑峴傢傟偰偄傞86)丅
GI cancer-net
徚壔婍娻帯椕偺峀応